撰文:中山大学 浅蓝
本文审核专家:江苏大学附属医院 李晶教授
引言
随着时光的推移,我们不得不面对一个现实:年龄越大,人体内间充质干细胞的数量和功能也越衰退。这种变化是生命进程中的一个自然现象,但也提醒着我们要更加关注健康和保养。今年,发表在Journal of Translational Medicine杂志上的文献揭露,年龄增长会对间充质干细胞功能产生负面影响,而这种与年龄相关的改变可能不利于干细胞治疗的成功。同时文献也建议,由于间充质干细胞可以低温保存数十年而不会破坏其增殖和分化能力,因此建议早期保存自体间充质干细胞以避免与年龄相关的损伤。
随着医疗技术的进步,人类的平均寿命显著延长。然而,伴随着寿命的延长,老年人群中与年龄相关的疾病也在增加,例如骨质疏松、关节炎和心血管疾病等。这些疾病的发生往往与体内组织再生和修复能力的下降有关。这主要是跟人体内的干细胞衰老有关系。
间充质干细胞(MSCs)因其可以分化为多种细胞类型(如骨细胞、软骨细胞和脂肪细胞)而在再生医学中具有广泛的应用前景。在临床疾病的诊疗过程中,MSCs已经展现出了跨越多系统疾病治疗的巨大潜力[1],为无数患者带去了生命的希望。然而,在深入挖掘MSCs应用潜力的同时,一个关键却常被忽视的问题逐渐浮出水面——年龄对MSCs功能特性的影响。

(图片来自参考文献1)
实际上,年龄不仅关乎MSCs的获取难度与可行性,更直接关系到这些干细胞在治疗中的实际效能与安全性,因此,这一因素在临床应用中显得尤为关键,深入剖析并全面理解不同年龄段间充质干细胞的功能差异,成为了推动临床治疗精准化、高效化的关键一环。
近期,发布在“Journal of Translational Medicine”上的一篇名为“Donor age negatively impacts adipose tissue-derived mesenchymal stem cell expansion and differentiation”的研究就探讨了不同年龄段(年轻、中年和老年)来源的间充质干细胞(MSCs)的扩增和分化能力的差异[2]。研究者将参与者按照年龄分为3组,年轻组(<30岁)、成人组(35-50岁)和老年组(>60岁),并对他们的MSCs进行扩增和体外分化潜力等检测。
结论
这项研究表明,年龄对间充质干细胞(MSCs)的功能特性具有深远影响,不仅限制了其在临床应用中的扩增效率和分化潜能,还加剧了细胞老化等现象,从而严重影响了治疗效果的稳定性和安全性。
结论一:
随着年龄的增加,MSCs的扩增能力显著下降
研究表明,随着年龄的增加,MSCs的扩增能力显著下降。在实验中,研究人员比较了来自不同年龄段(年轻、中年和老年)捐赠者的MSCs的扩增情况。结果如下图所示,年轻个体的细胞在体外培养时,能够快速增殖并形成更大的细胞群,而老年个体的细胞增殖速度较慢,形成的细胞群较小。

(图片来自参考文献2)
具体而言,年轻个体中的MSCs的最大增殖次数(PD)较高,倍增时间(DT)较短。简单来说,就是年轻个体中的MSCs能够在较短的时间内完成更多的细胞分裂循环,而老年个体中的MSCs则需要更长的时间。此外,老年个体中的MSCs在培养过程中更容易出现细胞老化现象,如细胞体积增大、形态改变以及β-半乳糖苷酶活性增加等。这些老化特征不仅影响细胞的增殖能力,还可能对细胞的分化潜力产生负面影响。
结论二:
随着年龄的增加,MSCs的分化能力显著下降
不同年龄段的MSCs除了在增殖方面有显著差异外,在分化能力方面也表现出显著差异。研究人员分别评估了这些细胞向骨细胞、软骨细胞和神经细胞的分化能力。
1.成骨分化能力:年龄大的个体表现更差
与年轻个体中的MSCs相比,老年个体中的MSCs在成骨分化实验中表现欠佳。如下图Von Kossa染色显示,老年个体中的MSCs的矿化基质形成较少,成骨相关基因(如骨钙素和碱性磷酸酶)的表达也显著降低。

(图片来自参考文献2)
由上图我们可以明显看出年轻个体中的MSCs在成骨分化过程中能够形成更多的钙化结节,这表明它们在骨组织再生中具有更高的潜力。与之相反,老年个体中的MSCs的成骨能力显著下降,这可能会影响其在骨折愈合和骨质疏松治疗中的应用。
2.软骨分化能力:年龄大的个体表现更差
谈及完MSCs向骨细胞分化能力之后,让我们将目光聚焦到软骨分化能力上面。研究者对受试者的MSCs进行了Alcian blue染色和基因表达分析等检查。研究表明,老年个体中的MSCs在软骨基质形成和软骨相关基因(如聚集蛋白聚糖和II型胶原蛋白)表达方面均不及年轻个体中的MSCs。主要实验结果见下图。

(图片来自参考文献2)
从上面的实验结果我们可以发现,年轻个体中的MSCs在软骨分化过程中能够形成更丰富的软骨基质,而老年个体中的MSCs的软骨形成能力却显著下降。这一现象的发生可能与软骨细胞在老化过程中分泌的细胞外基质成分变化有关。
3.神经分化能力:没有显著差异
与分化为骨细胞和软骨细胞不同,在MSCs分化为神经细胞的初期分化阶段,各年龄段细胞的神经样分化潜力没有显著差异。如下图所示,免疫细胞化学分析显示,各年龄段细胞的巢蛋白(nestin)表达水平相似,神经特异性基因(如NFM和NSE)的表达也无显著差异。
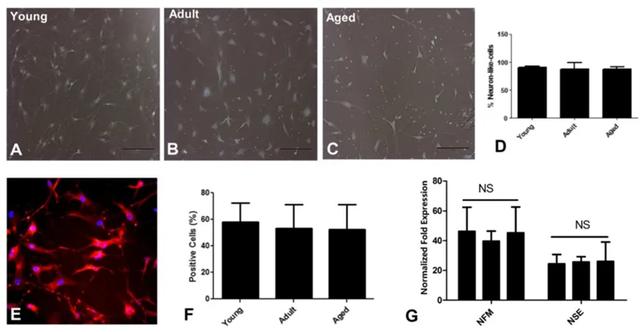
(图片来自参考文献2)
但值得注意的是,老年个体中的MSCs在分化后期中的神经分化能力较年轻个体而言还是有所下降的。
结论三:
老年个体中的MSCs更易受到损伤
细胞老化是影响MSCs功能的一个重要因素。随着年龄的增加,细胞内累积的氧化应激和DNA损伤增加,导致细胞老化的发生。在实验中,研究人员通过检测细胞内的β-半乳糖苷酶活性、p16和p21基因表达水平等指标来评估细胞的老化程度(实验结果见下图)。结果表明,老年个体中的MSCs在这些老化指标上较年轻个体均表现出显著增加,这与MSCs增殖能力下降和分化潜力减弱相一致。

(图片来自参考文献2)
此外,研究还发现,老年个体中的MSCs的超氧化物歧化酶(SOD)活性显著降低。SOD是一种抗氧化酶,能够清除细胞内的超氧化物自由基,保护细胞免受氧化损伤。SOD活性的降低意味着老年个体中的MSCs在面对氧化应激时更容易受到损伤,从而加速细胞老化。这一发现提示,抗氧化治疗可能在改善老年个体中的MSCs功能方面具有潜在的应用价值。
小结
随着时光的推移,我们不得不面对一个现实:1、年龄越大,人体内干细胞的含量就越低;2、随着年龄增长,人体干细胞的功能表现越差,分化能力也有所下降。
在青春年少时,干细胞在体内的数量丰富,如同充足的“后备军”,时刻进行着组织的修复和再生,
然而,当岁月的车轮不断前行,间充质干细胞的数量开始逐渐减少;
同时,随着年龄变大,干细胞的功能也逐渐衰退,原本强大的分化能力变得迟缓;
这样的机制,给年轻的个体带来了更强的修复能力,也部分解释了老年人的机体恢复为何更加艰难的原因。
因此,建议尽早保存间充质干细胞,以避免与年龄相关的损伤。
另外,由于间充质干细胞免疫原性低,亲缘间的使用相对安全,
所以,伴随新生儿诞生的来源于胎盘/脐带组织的间充质干细胞被称为“0岁细胞”,受到广泛关注,越来越多的家庭都趁孩子出生的时候进行存储。
未来,深入探究年龄相关机制,优化间充质干细胞的筛选、保存与扩增策略,以及开发针对老年间充质干细胞的功能增强技术,将成为再生医学领域的重要研究方向。通过科学界的不断努力,我们有理由相信,随着对间充质干细胞功能特性与年龄关系的全面理解,我们将能够更有效地利用这一强大的细胞资源,为延长人类健康寿命、改善老年疾病治疗提供更为精准和高效的解决方案。
参考文献:
[1] Clinical utility of mesenchymal stem/stromal cells in regenerative medicine and cellular therapy | Journal of Biological Engineering[EB/OL]. [2024-07-15].
链接:https://link.springer.com/article/10.1186/s13036-023-00361-9#citeas.
[2] Choudhery M S, Badowski M, Muise A, et al. Donor age negatively impacts adipose tissue-derived mesenchymal stem cell expansion and differentiation[J]. Journal of Translational Medicine, 2014, 12(1): 8.
链接:https://translational-medicine.biomedcentral.com/articles/10.1186/1479-5876-12-8
[3] Aging of mesenchymal stem cells: Implication in regenerative medicine
