各位专家同道好,本期CDM月评(第九十九期)将分享近期的门静脉高压诊疗领域6篇文献(诊断监测3篇,多学科治疗3篇)。本期特邀月评专家:南京大学医学院附属鼓楼医院感染科黄睿教授、南方医科大学珠江医院检验医学部李壮教授、东南大学附属中大医院放射科叶必成博士。
 01 新型CORE评分在普通人群中预测10年肝硬化风险的应用:一项基于人群的队列研究
01 新型CORE评分在普通人群中预测10年肝硬化风险的应用:一项基于人群的队列研究Strandberg R, Åberg F, Asteljoki JV, Luukkonen PK, Salomaa V, Jula A, Lundqvist A, Männistö S, Perola M, Talbäck M, Hammar N, Hagström H. Use of new CORE risk score to predict 10 year risk of liver cirrhosis in general population: population based cohort study. BMJ. 2025 Sep 29.
肝硬化是全球第11位死因,但往往在严重并发症出现前处于无症状状态,因此早期识别高危人群至关重要。现有的纤维化评估工具如FIB-4评分主要用于检测当前纤维化程度,而非预测未来风险。近日,来自瑞典卡罗林斯卡学院的Rickard Strandberg等人开发并验证一种新型风险预测模型CORE(Cirrhosis Outcome Risk Estimator),用于预测普通人群中10年肝硬化及其并发症的发生风险。相关内容发表在BMJ杂志上。
这项基于人群的队列研究使用瑞典AMORIS队列开发模型,并在芬兰FINRISK/Health2000队列和英国生物银行队列中进行外部验证。研究纳入480 651例无已知肝病史且在初级医疗或职业健康体检中接受血液检查的成年人进行模型开发,另有24 191例和449 806例无已知肝病史的个体分别在两个验证队列中接受验证。主要结局为10年内发生重大不良肝脏结局(MALO)的风险,包括代偿性和失代偿性肝硬化、肝细胞癌(HCC)、肝移植和肝脏相关死亡的复合结局。研究采用灵活参数生存模型构建预测模型,包含年龄、性别、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)和γ-谷氨酰转移酶(GGT)等易获得的实验室指标。通过时间依赖的曲线下面积(AUC)评估区分度,校准曲线评估校准度,决策曲线分析评估临床实用性,并与FIB-4评分进行比较。
本研究中位随访时间为28年,共观察到7 168例MALO事件。10年MALO发生率为0.27%。CORE模型的10年AUC为88%(95%CI:87%-89%),而FIB-4为79%(95%CI:78%-80%)。在外部验证中,CORE在FINRISK队列的10年AUC为0.81(95%CI:0.77-0.87),在英国生物银行队列为0.79(95%CI:0.78-0.80),均优于FIB-4(英国生物银行队列中为0.73,95%CI:0.72-0.74)。CORE在所有三个队列中均显示良好的校准度。在相同的敏感度0.53时,CORE的特异度为0.96,而FIB-4(截断值1.30)的特异度仅为0.86。决策曲线分析显示,在所有风险阈值下,CORE提供的净获益均高于FIB-4。敏感性分析和Bootstrap验证均支持上述发现。
因此,本研究认为基于易获得的生物标志物开发的CORE模型,在预测普通人群肝脏相关结局方面优于FIB-4,可作为初级医疗中对肝病高危人群进行风险分层的新型工具。

简评丨叶必成
东南大学附属中大医院放射科
这篇文章探讨了一种新的风险评估工具——肝硬化结局风险评估模型(CORE),旨在预测普通人群在十年内发生重大肝脏不良事件(MALO)的风险。该研究基于一个大型人群队列,主要在瑞典进行,并在芬兰和英国进行了验证。研究对象包括480 651例没有肝病史的个体,结果显示,CORE模型在评估肝硬化及相关疾病的风险方面表现出色。
通过与FIB-4的比较,CORE在辨别肝脏疾病风险方面表现出更高的灵敏度和特异性。这一点在决策曲线分析中得到了体现,CORE在所有风险阈值下提供的净收益都超过了FIB-4。该模型的建立不仅为普通人群的肝脏健康评估提供了一种新工具,还为临床决策提供了数据支持。
然而,文章也提到了一些局限性,包括研究的历史数据以及可能影响模型外推能力的人群异质性。尽管如此,CORE模型在筛查普通人群中具有潜在的广泛应用价值,能够帮助早期识别肝脏疾病患者,并为后续的医学干预提供基础。此外,未来需要在不同的地域和高危群体中进一步验证CORE模型的有效性。
总结来说,这项研究不仅展示了CORE模型在预测肝脏疾病风险方面的优势,还强调了早期发现和管理肝病的重要性,从而可能改善患者的预后。
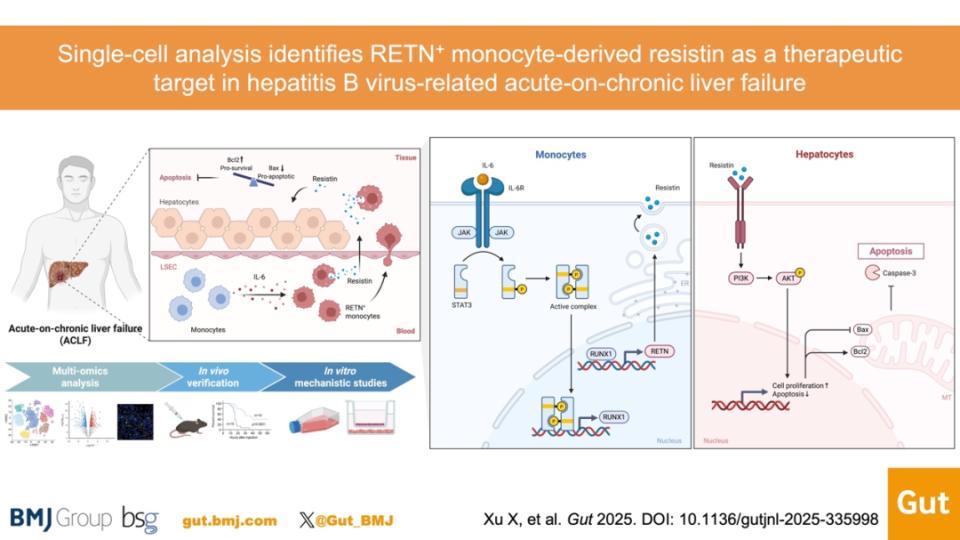
02 单细胞分析鉴定RETN+单核细胞来源的Resistin为乙型肝炎相关慢加急性肝衰竭的潜在治疗靶点Xu X, Chen J, Yu X, Li Z, Chen J, Fang D, Lin X, Tu H, Xu X, Yang S, Cheng J, Gong K, Weng H, Yu Y, Zhang X, Lan Y, Li B, Cao G, Chen H, Chen L, Qian X, Han W, Jiang M, Du W, Yang Y, Sheng J, Wu X, Shi Y. Single-cell analysis identifies RETN+ monocyte-derived Resistin as a therapeutic target in hepatitis B virus-related acute-on-chronic liver failure. Gut. 2025 Oct 6.
慢加急性肝衰竭(ACLF)的特征是剧烈的全身炎症反应及极高的短期病死率,但目前仍缺乏有效的靶向治疗手段。近日,来自浙江大学医学院附属第一医院的YuShi等人,探索了乙型肝炎相关慢加急性肝衰竭(HBV-ACLF)患者外周单核细胞的异质性,鉴定了其中特异性细胞亚群及其相关的潜在治疗靶点。相关成果发表在Gut杂志上。
该研究采集了健康对照者(n=4)、急性失代偿患者(n=5)及ACLF患者(n=9)的外周血单个核细胞,行单细胞RNA测序(scRNA-seq)。研究结果进一步与肝脏组织的单细胞转录组、整体转录组数据、多重免疫组化以及体外功能实验进行综合分析。候选靶点在两种小鼠ACLF动物模型中通过体内实验加以验证。
作者团队鉴定出一类独特的RETN+单核细胞亚群,该亚群在HBV-ACLF患者的外周血及肝组织中均显著扩增。RETN+单核细胞呈现富集的抗炎和促炎症消退型转录程序。白细胞介素-6通过激活JAK/STAT3/RUNX1信号通路促进RETN+单核细胞的扩增。在小鼠ACLF模型中,中和Resistin可加重肝损伤,提高全身炎性细胞因子水平,并增加肝细胞凋亡。相反,给予重组Resistin可减轻肝组织损伤,降低炎性细胞因子水平,并改善动物生存率。在机制层面,Resistin能激活肝细胞内的PI3K/AKT信号通路,维持Bcl-2/Bax比例平衡,从而抑制线粒体途径(内源性)细胞凋亡。在临床上,HBV-ACLF患者血浆Resistin水平与全身炎症标志物、肝损伤程度、ACLF严重程度评分(MELD评分、慢性肝衰竭联盟ACLF评分)以及短期病死率均呈显著负相关。
结论:RETN+单核细胞构成HBV-ACLF中一类独特的免疫调节性单核细胞亚群,其分泌产物Resistin具有显著的保肝及抗炎作用。本研究提示,RETN+单核细胞及Resistin有望成为HBV-ACLF的新型免疫治疗靶点。
简评丨黄睿
南京大学医学院附属鼓楼医院感染科
HBV-ACLF病死率极高且缺乏有效的药物治疗手段,深入阐明其发病机制、寻找新的治疗靶点尤为关键。该研究团队利用单细胞测序分析,结合细胞与动物实验,从整体到细胞、从机制到临床构建了系统而完整的证据链,揭示了RETN+单核细胞及其分泌的Resistin在HBV-ACLF中的重要保护作用。
研究显示,在HBV-ACLF患者中,一个特殊的RETN+单核细胞亚群显著扩增,并呈现不同于经典单核细胞的“抗炎与损伤修复型”转录特征。进一步机制分析表明,该亚群的形成受IL-6/JAK/STAT3信号通路调控。功能实验也明确了Resistin的保护作用:在两种小鼠ACLF模型中,外源补充Resistin可显著减轻肝坏死、降低炎症水平并改善生存,而阻断Resistin则会加重肝损伤。机制上,Resistin可能通过激活PI3K/AKT通路抑制肝细胞内源性凋亡。临床数据进一步显示,血浆Resistin水平与肝损害程度、系统炎症水平及短期生存率密切相关,提示其不仅具备作为预后生物标志物的潜力,也有望成为未来HBV-ACLF的免疫治疗关键靶点。
总体而言,该研究从单细胞视角揭示了RETN+单核细胞及Resistin在HBV-ACLF发病重要免疫调控机制,为这一重症肝病的治疗探索带来了新的可能性和转化契机。
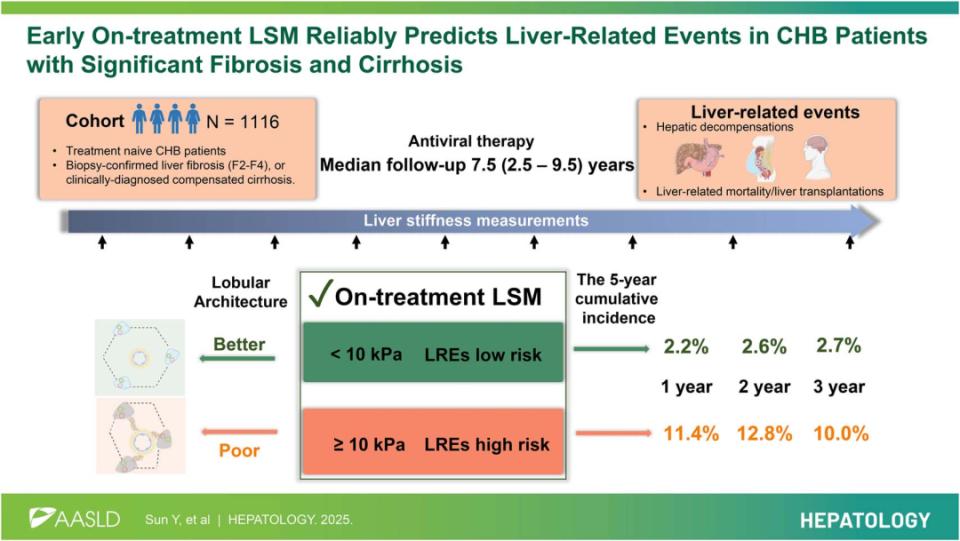
03 早期抗病毒治疗期间的肝硬度测量可预测伴显著纤维化或肝硬化的慢性乙型肝炎患者肝相关事件发生Sun Y, Chen S, Xu X, Piao H, Chen G, Jiang W, Chen Y, Xu M, Ding H, Xie W, Xu X, Ma H, Ma A, Meng T, Zhou J, Wang B, Zhang M, Ou X, Zhao X, Jia J, Wu X, You H. Early on-treatment LSM reliably predicts liver-related events in CHB patients with significant fibrosis and cirrhosis. Hepatology. 2025 Sep 1.
目前,在病因学治疗过程中,比较动态随访肝硬度测量(LSM)与单一治疗中时间点LSM在预测临床结局方面价值的证据仍然有限。近日,来自首都医科大学附属北京友谊医院HongYou等人,评估了接受抗病毒治疗的慢性乙型肝炎(CHB)患者治疗期间LSM的预后价值。相关成果发表在Hepatology杂志上。
该前瞻性队列纳入伴显著肝纤维化或肝硬化的CHB患者。肝相关事件(LREs)定义为肝功能失代偿、肝移植或肝相关死亡。作者分析了基线LSM、治疗期间LSM以及LSM动态变化与LREs之间的关联。共纳入1116例CHB患者,其中875例(78.4%)诊断为肝硬化,中位随访时间为7.5(2.5-9.5)年。与基线LSM(AUROC:0.59-0.65)及LSM变化(AUROC:0.42-0.65)相比,抗病毒治疗后1-3年时的治疗期LSM是3年及5年结局最可靠的预测因子(AUROC:0.72-0.78)。在接受1年、2年或3年抗病毒治疗后,LSM<10 kPa的患者发生LREs的风险显著降低,其5年累积发生率分别为2.2%、2.6%和2.7%。这一结果在肝硬化亚组、外部验证队列以及以失代偿作为单一终点的分析中同样得到证实。值得注意的是,治疗期LSM<10 kPa的患者在肝活检评估中表现出更好的肝小叶结构重塑。
结论:在抗病毒治疗后1-3年测得的治疗期LSM,相较基线LSM或LSM动态变化,对LREs具有更优的预测准确性,其中LSM<10 kPa提示显著降低的肝相关事件风险,这可能与肝小叶结构的改善有关。
简评丨黄睿
南京大学医学院附属鼓楼医院感染科
LSM检测已广泛应用于多种肝病的无创肝纤维化评估、治疗策略制定、疗效监测及预后判断。目前,针对CHB患者的研究多集中于基线LSM对肝纤维化程度和预后的预测价值,而关于抗病毒治疗过程中LSM的动态变化与临床结局之间的关系研究相对较少。该研究为一项多中心、前瞻性的大样本队列研究,纳入来自41家医院的1116例CHB患者,中位随访7.5年,并额外纳入来自31家医院的442例患者作为外部验证队列。研究评估了治疗早期LSM变化与后续肝脏不良事件风险之间的关联。结果显示,治疗后1-3年内LSM<10 kPa的患者,其发生肝病相关事件(肝硬化失代偿、肝病相关死亡/肝移植)的风险明显低于LSM仍≥10 kPa的患者,且其预测能力优于基线LSM或LSM变化幅度。
该研究的优势包括采用前瞻性、多中心设计、较长的随访时间,并通过外部验证进一步增强了研究结果的稳健性。然而,研究也存在一定局限性。首先,研究人群中78.4%为肝硬化患者,因此治疗后LSM在非肝硬化CHB人群中的预后价值及最佳cut-off仍需进一步探索。其次,LSM容易受到BMI等多种因素影响,因此该研究提出的10 kPa截断值在不同疾病状态及合并症(如肥胖)的CHB患者中的预测准确性仍需进一步验证。此外,研究中所有患者均接受核苷(酸)类似物治疗,虽然有小部分(13.4%)患者曾联合使用PEG-IFN-α,但研究结果是否适用于以PEG-IFN-α为主的治疗方案仍需进一步研究。
总体而言,该研究强调了治疗后LSM动态监测的重要性。对于CHB患者来说,不仅应关注治疗前的基线LSM,更应重视治疗过程中LSM水平的变化,因为其在预测后续肝病不良事件方面具有更高价值。该研究为拓展LSM在CHB患者的诊疗与风险分层中的应用提供了关键证据,有助于制定更精准的随访策略和个体化管理方案。
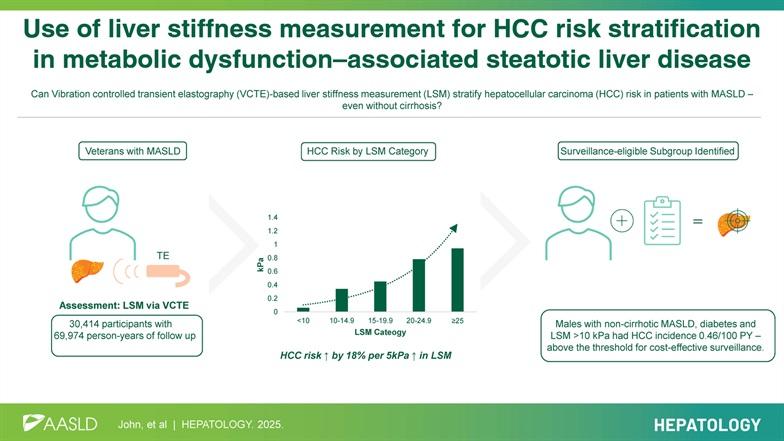
04 代谢相关脂肪性肝病中应用肝硬度测量进行肝细胞癌风险分层John BV, Bastaich DR, Deng Y, Singal AG, Dahman B; Veterans Analysis of Liver Disease (VALID) group of investigators. Use of liver stiffness measurement for HCC risk stratification in metabolic dysfunction-associated steatotic liver disease. Hepatology. 2025 Aug 14.
代谢相关性脂肪性肝病(MASLD)是HCC的最快增长病因,但约三分之一的MASLD相关HCC发生在无肝硬化的患者中,预测工具仍然缺乏。近日,来自美国迈阿密VA医疗中心的Binu V. John等人探讨肝脏硬度测量值(LSM)与MASLD患者HCC风险的关联,并评估LSM阈值能否识别需要进行具有成本效益的HCC监测的患者。相关内容发表在Hepatology杂志上。
这项回顾性队列研究纳入了退伍军人肝病分析(VALID)队列中2014年5月27日至2023年1月5日期间接受瞬时弹性成像检查的MASLD患者。研究计算了HCC发病率,并采用多变量Cox比例风险模型分析LSM与HCC风险的关联。不良临床结局定义为HCC发生、肝移植或死亡。LSM分为<10、10-14.9、15-19.9、20-24.9和≥25 kPa五个类别。同时采用Fine-Grey方法处理肝移植和死亡作为竞争风险,调整了年龄、性别、种族、体重指数、糖尿病和吸烟状态等变量。
该研究共纳入30 414例MASLD患者,随访69 974人年,共发生132例HCC。LSM每增加5 kPa,HCC风险增加18%(亚分布风险比sHR:1.18,95%CI:1.14-1.21)。不同LSM水平的年HCC发病率分别为:LSM 10-14.9 kPa时0.34/100人年(95%CI:0.24-0.49),LSM 15-19.9 kPa时0.45/100人年(95%CI:0.27-0.76),LSM 20-24.9 kPa时0.78/100人年(95%CI:0.50-1.20),LSM≥25 kPa时0.94/100人年(95%CI:0.68-1.29)。在无肝硬化或临床显著门脉高压的MASLD患者中,合并糖尿病且LSM≥10 kPa的患者年HCC发病率为0.46/100人年(95%CI:0.29-0.78),超过了成本效益监测阈值(0.4/100人年)。此外,年龄增长(sHR:1.70)和糖尿病(sHR:2.80)也与HCC风险增加相关。敏感性分析和亚组分析均支持上述发现。
因此,本研究认为LSM与MASLD患者HCC风险显著相关,可用于HCC风险分层。对于无肝硬化的MASLD患者,若合并糖尿病且LSM≥10 kPa,应考虑进行HCC监测。
简评丨叶必成
东南大学附属中大医院放射科
这篇文章的主题聚焦于代谢相关脂肪肝疾病(MASLD)作为HCC发展的一个重要风险因素,尤其是对于那些未表现为肝硬化的患者。这项研究的重点是通过肝脏硬度测量(LSM)来评估HCC的风险并提出监测建议。根据研究,LSM的每增加5 kPa,HCC的风险就会增加18%,这一发现突显出LSM在早期识别高风险患者方面的潜力。文章提到,当前的医学指导并不建议对没有肝硬化的MASLD患者进行常规HCC监测,主要是因为这些患者的HCC发生率较低。但研究结果显示,对于糖尿病患者和LSM≥10 kPa的非肝硬化MASLD患者,其HCC年发生率高达0.46每100人年,超过了成本效益监测的阈值。
文章的方法论也十分扎实,采用了回顾性队列研究设计,收集了30 414例MASLD患者的数据,追踪观察他们的HCC发生情况。研究充分利用了多变量Cox比例风险模型来分析LSM和HCC之间的关联,并清楚地与其他潜在的影响因素(如年龄、性别、糖尿病等)进行了比较。这些结果为临床医生在选择监测策略时提供了参考,特别是在面临如何平衡成本和效益的情况下。
不过,文章也承认了一些局限性,如样本主要来自男性退伍军人,可能影响结果的普遍适用性。此外,由于本研究是回顾性的,因此可能存在未观察到的混杂因素或选择偏差等问题。
总结来说,这项研究为MASLD患者的HCC风险评估提供了新的视角,特别是在没有显著肝硬化的情况下,LSM可以作为一种有效的工具来识别高风险患者。研究者们呼吁在临床上应用LSM作为HCC监测的一部分,以改进患者的管理和预后。这无疑为未来的肝病研究指明了方向。
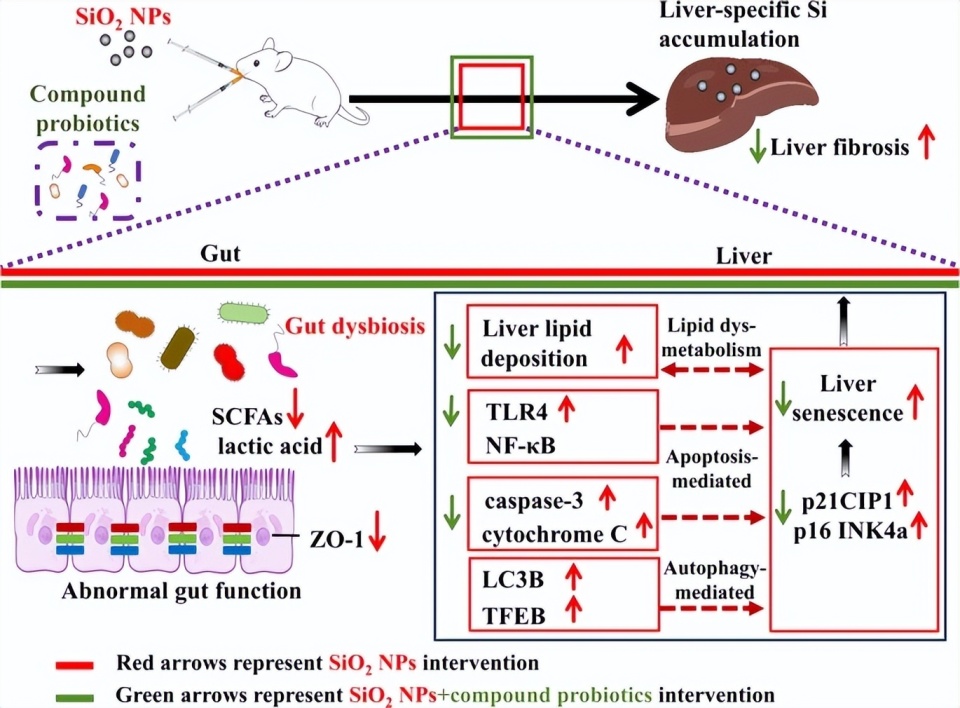
05 口服纳米二氧化硅通过微生物-肠-肝轴导致肝脏特异性蓄积并诱导肝衰老与纤维化Han X, Du L, Dou Y, Wang H, Lv M, Wang L, Xiao J, Yin J, Wu J. Orally ingested nanosilica causes liver-specific accumulation and induces liver senescence and fibrosis via the microbiota-gut-liver axis. J Nanobiotechnology. 2025 Oct 10.
随着纳米二氧化硅(SiO2纳米颗粒,SiO2 NPs)应用的日益广泛,其潜在安全性风险日渐受到关注。目前,对于口服SiO2 NPs在体内的组织分布特征以及其经由微生物-肠-肝轴介导的毒性机制仍缺乏系统性认识。近日,来自大连大学附属中山医院的Xiaofei Han等人,通过灌胃方式给予SiO2 NPs,考察其在主要器官中的分布,以及亚慢性口服暴露后经微生物-肠-肝串联作用所诱导的肝脏衰老和纤维化损伤;同时,进一步评估益生菌干预对SiO2 NPs相关肝毒性的保护作用。相关内容发表在J Nanobiotechnology杂志上。
研究结果显示,经口服SiO2 NPs连续暴露12周的C57BL/6J小鼠出现明显肠道菌群失调、代谢产物(短链脂肪酸和乳酸)失衡、肠屏障损伤以及肠道稳态破坏。电感耦合等离子体光学发射光谱(ICP-OES)检测提示,Si在肝脏中明显蓄积,其含量较对照组升高165%,且高于其他组织。肝脏表现出功能异常,并伴有脂质沉积、自噬活性改变、细胞衰老及纤维化。16S rRNA测序分析显示,SiO2 NPs暴露降低了益生菌Muribaculum和Ligilactobacillus的丰度,同时增加了致病性Helicobacter的丰度。值得注意的是,益生菌补充可重塑肠道微生物群,尤其可纠正SiO2 NPs所致的微生群落失衡,促进其他益生菌增殖并减少有害菌。进一步的Masson染色、Nile red染色及免疫荧光结果证实,益生菌干预可减轻口服SiO2 NPs引起的肝脂质沉积、细胞衰老及纤维化。机制上,TLR4/NF-κB信号通路以及caspase-3-细胞色素C(cytochrome C)通路可能参与了SiO2 NPs诱导的肝毒性及其受益生菌调控的过程。
结论:持续口服SiO2 NPs可导致其在肝脏内特异性蓄积,并通过微生物-肠-肝轴介导异常肝脂质沉积、细胞衰老及纤维化发生。通过补充益生菌的微生物治疗干预可减轻SiO2 NPs相关肝毒性并发挥保护作用。本研究为SiO2 NPs的合理应用、风险管理及有害效应防控提供了科学依据。
简评丨李壮
南方医科大学珠江医院检验医学部
随着SiO2 NPs在食品、医药及日化等领域的广泛应用,其潜在生物安全性问题备受关注。既往研究多集中于经吸入或注射途径的毒理效应,而经口摄入后在体内的分布规律及通过“微生物群-肠-肝”轴引发的系统毒性机制尚不清楚。本研究聚焦于这一关键科学空白,探讨了SiO2 NPs口服暴露后在主要脏器的分布特征、肠道屏障损伤以及肠-肝互作导致的肝毒性反应。
该研究首次发现,持续12周口服SiO2 NPs可导致肝脏特异性硅积累,并引发肠道菌群失衡、屏障破坏及代谢产物紊乱(SCFAs下降、乳酸升高),最终诱导肝脏脂质沉积、衰老及纤维化。同时,机制研究揭示TLR4/NF-κB与caspase-3/cytochrome C信号通路参与其中。更为重要的是,补充益生菌可重塑肠道微生态,恢复肠屏障功能,减少有害菌并提升有益菌丰度,从而显著缓解SiO2 NPs诱导的肝损伤。这为益生菌作为纳米材料毒性防护手段提供了新的科学依据。
尽管结果具有重要启示意义,但仍存在一定不足。首先,研究未追踪SiO2 NPs在消化道不同时间点的代谢与排泄过程,难以精确揭示其生物转运路径。其次,缺乏无菌动物模型以明确肠道菌群在毒性发生中的因果作用。此外,益生菌的保护作用机制仍需通过靶向菌株或代谢产物实验进一步验证。
总体而言,本研究填补了SiO2 NPs经口暴露后肠-肝毒性机制研究的空白,提出了以益生菌为核心的微生态干预思路,具有重要的科学意义和潜在应用价值。
06 代谢相关脂肪性肝病患者连续粪菌移植治疗的随机对照试验Groenewegen B, Ruissen MM, Crossette E, Menon R, Prince AL, Norman JM, Ballieux BEPB, Lamb HJ, Terveer EM, Keller JJ, Tushuizen ME. Consecutive fecal microbiota transplantation for metabolic dysfunction-associated steatotic liver disease: a randomized controlled trial. Gut Microbes. 2025 Aug 4.
肠道微生物群日益被认为在MASLD的发生发展中发挥重要作用。近日,来自荷兰莱顿大学医学中心的Bas Groenewegen等人进行了一项随机、双盲对照试验,旨在评估连续三次粪菌移植(fecal microbiota transplantation, FMT)对MASLD患者肝脏脂肪变性的影响。相关成果发表在Gut Microbes杂志上。
该研究团队将20例MASLD患者按1:1比例随机分配,于第0、3和6周接受同种异体或自体FMT,并随访至第12周。FMT菌悬液来源于两名健康供者。研究评估了肝脏脂肪变性(采用磁共振质子密度脂肪分数,MRI-PDFF)、口服葡萄糖耐量试验、肝生化指标以及肠道微生物群组成/定植情况的变化。
结果发现,基线至第12周MRI-PDFF的变化在两组间差异无统计学意义(P=0.50)。肝生化指标和葡萄糖耐量亦未见整体上有显著改变。患者粪便微生物群在基线时表现出较高的α多样性,且两组间菌群组成相似,但至第12周出现分化(P=0.02)。其中,分别隶属于Gastranaerophilaceae科和Rikenellaceae科的两个微生物分类单元与FMT后甘油三酯水平相关。未发现其他与FMT治疗方式或临床应答相关的肠道微生物群特征。供体菌群的定植模式表现为供体特异性,但与治疗分组或应答状态无明显相关性。
因此,FMT未对肝脏脂肪变性、葡萄糖耐量、肝生化指标或肠道微生物群特征产生显著影响。未来研究应考虑纳入基线肠道微生物多样性较低的人群。

简评丨李壮
南方医科大学珠江医院检验医学部
本研究以MASLD患者为研究对象,系统评估了FMT在改善肝脂肪沉积和代谢功能方面的潜在作用。研究采用双盲随机对照设计,比较了FMT对肝脏脂肪含量、肝功能及葡萄糖代谢的影响,旨在探讨通过调节肠道微生态改善MASLD的科学依据。
结果表明,连续三次FMT在12周随访期内未显著改善患者的肝脂积聚、肝功能或糖代谢水平,但观察到两组间肠道菌群结构在干预后出现差异,提示FMT可在一定程度上改变受体的微生物组成。然而,这种结构性变化并未直接转化为明显的代谢获益。研究还发现,FMT的菌群定植具有明显的供体特异性,而患者基线菌群多样性较高可能限制外源菌群的持久定植与生理效应。这一结果暗示,患者自身微生态背景及与供体菌群的兼容性,是决定FMT疗效的重要因素。
该研究的创新在于,首次在MASLD人群中采用三次连续FMT结合MRI-PDFF定量技术,实现了肝脂变化的精确监测,并系统分析了宿主菌群状态、供体特征与菌群定植之间的关联。研究从临床层面证实,FMT作为代谢性肝病干预手段的效果有限,同时揭示了其生物学复杂性,即FMT效应不仅取决于供体菌群质量,更与宿主生态结构和代谢状态密切相关。
总体而言,本研究以严格的随机对照设计和多维度微生态分析,验证了FMT在MASLD患者中的短期疗效有限,为理解肠道菌群—宿主互作及其在代谢性肝病中的作用机制提供了重要证据,但仍需通过更大样本、长周期、严格控制干预变量及综合组学分析,进一步阐明其作用机制与个体化应用潜力。未来应结合患者个体菌群特征、优化供受体匹配策略,并探索更精准的微生态干预方式,为MASLD的个体化治疗提供新的思路与方向。