2025年12月,《血液与肿瘤学杂志》发表了来自南开大学、上海同济医院、天津第一中心医院等机构的突破性研究。

这项针对复发/难治性急性髓系白血病(R/R AML)的临床试验显示:
38例患者接受CLL1 CAR-T治疗后,客观缓解率为73.68%,42.11%患者实现微小残留病灶阴性完全缓解,31.57%患者达到微小残留病灶阳性完全缓解。髓外浸润患者同样显著获益:60%的髓外浸润患者获得客观缓解,其中5例实现微小残留病灶阴性完全缓解。
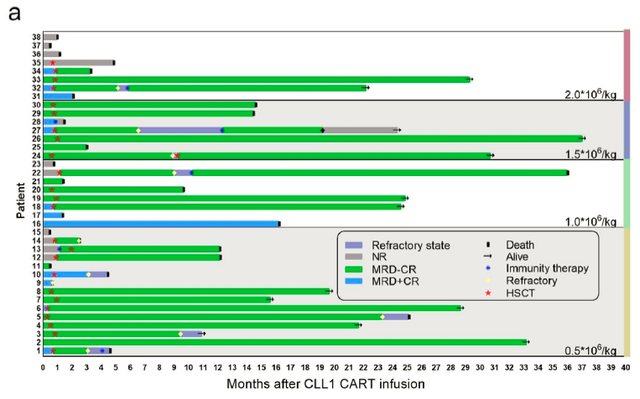
生存数据令人振奋,中位无进展生存期(PFS)达9个月,中位总生存期(OS)为12.17个月,两年总生存率突破51.43%。
19例接受CAR-T后桥接异基因造血干细胞移植的患者有94.73%在移植后达到微小残留病灶阴性完全缓解,移植组中位总生存期达26.25个月。
这项研究为急性髓系白血病患者提供了全新的治疗路径,证实CAR-T疗法可作为有效的移植桥梁,显著提升长期生存率。
CAR-T细胞疗法作为近年来最具突破性的生物医疗技术之一,正深刻改变着癌症和治疗格局。这种细胞治疗方法通过对患者免疫细胞进行基因改造,使其获得精准识别并攻击癌细胞的能力。

随着技术迭代升级,CAR-T疗法已从最初的血液肿瘤治疗,逐步扩展到实体瘤、自身免疫性疾病领域,为众多难治性疾病患者带来了新希望。
实体瘤治疗突破
虽然实体瘤的物理屏障、免疫抑制微环境以及靶点选择困难,限制了CAR-T疗效。
然而,临床研究正在不断取得突破。华东师范大学刘明耀教授团队在Cancer Cell杂志上发表综述,系统总结了CAR-T细胞在多种实体瘤临床研究中的突破性进展。
针对肺癌的EGFR-CAR-T将患者的中位生存期提升至15.63个月;肝癌的GPC3-CAR-T、胃癌的CLDN18.2-CAR-T在临床研究中显示出高达90%以上的疾病控制率。
双靶点CAR-T使逾六成患者肿瘤缩小
在2025年美国临床肿瘤学会(ASCO)年会上发布的一项重磅研究显示,一种新型双靶点CAR-T疗法成功减缓了这种侵袭性极强、生长迅速的脑癌的肿瘤生长。
这项由宾夕法尼亚大学艾布拉姆森癌症中心研究人员进行,并同步发表于《自然医学》的I期临床试验结果表明:在接受实验性CAR-T细胞疗法后,近三分之二(62%)的患者肿瘤缩小。这对于平均生存期仅12-18个月、复发后中位生存期仅6-10个月的GBM患者而言,意义非凡。
宾夕法尼亚大学开发的这种CAR-T产品的独特之处在于它能同时靶向脑瘤中常见的两种蛋白:表皮生长因子受体(EGFR)和白介素-13受体α2(IL13Rα2),并通过脑脊液注射给药。
大多数患者肿瘤于1-3个月后再生的情况下,仍出现令人鼓舞的信号:2名患者(11%)存活且疾病稳定超过6个月;在随访至少12个月的7名患者中,3名(43%)在一年后仍然存活,其中一名患者疾病稳定超过16个月。
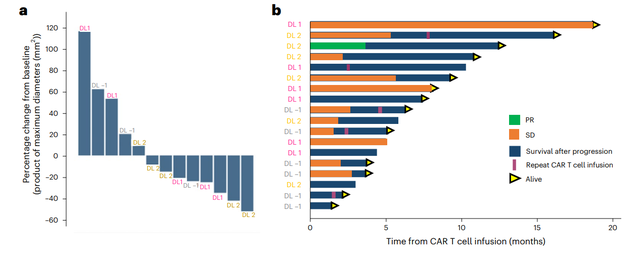
这些创新性CAR-T疗法在实体瘤患者中展示出了巨大潜力,随着对肿瘤免疫微环境认识的不断深入,对于CAR-T细胞的改造也越来越系统化、多样化。
体内CAR-T疗法
传统CAR-T疗法需提取患者T细胞,在体外进行基因改造后再回输体内,整个过程耗时长达数周,单次治疗费用高达50万美元。这种复杂的体外改造流程严重限制了CAR-T疗法的可及性。
浙江大学医学院附属儿童医院叶青教授、毛建华教授团队在Research杂志上发表综述,全面解析了体内CAR-T疗法的核心技术、多疾病应用潜力与创新解决方案。
体内CAR-T疗法通过病毒载体或纳米颗粒等“智能快递员”,直接将CAR基因送达患者体内T细胞,大幅简化流程并降低成本。
在安全性方面,体内疗法也展现出独特优势。它不仅规避了体外培养可能导致的细胞污染风险,还省去了传统治疗前的化疗环节,避免了由此引发的感染等副作用,使更多体弱患者也能受益。
已有早期临床数据显示,针对复发难治多发性骨髓瘤的体内BCMA-CAR-T疗法,客观缓解率可达100%。
自身免疫性疾病治疗
CAR-T疗法在自身免疫性疾病领域同样展现出巨大潜力。CAR-T细胞携带有合成受体,能够识别并结合表达与自身免疫反应相关靶蛋白的细胞。一旦结合,CAR-T细胞就会激活免疫系统攻击并清除这些目标自身免疫细胞。通过选择性靶向参与自身免疫过程的细胞,CAR-T疗法旨在抑制异常的免疫反应,并可能诱导自身免疫性疾病进入缓解状态。
临床数据显示,多例重度难治性系统性红斑狼疮患者接受CD19-CAR-T治疗后,实现了快速的B细胞耗竭、抗体水平下降以及蛋白尿缓解。最长随访29个月,患者均未出现复发情况。
创新技术前沿:国内外研究进展
全球科研团队正在推动CAR-T技术不断创新。美国在CAR-T领域处于技术领先地位,中国则紧跟美国。
复旦大学生物医学研究院徐建青和张晓燕教授团队设计的一种缺氧诱导转录放大系统,能严格区分肿瘤与正常组织,实现CAR-T在肿瘤微环境的条件性激活。
在载体技术方面,脂质纳米颗粒作为非病毒载体展现出巨大潜力,能实现精准靶向和可控表达。这些创新技术正推动CAR-T疗法向更安全、更精准、更经济的方向发展。
结语
CAR-T疗法为代表的细胞治疗已经展现出巨大潜力。但是尽管CAR-T疗法取得了显著进展,但仍面临安全性、成本、适应证拓展等多重挑战。细胞因子释放综合征和神经毒性是CAR-T治疗的主要安全隐患。未来随着技术不断成熟,CAR-T细胞治疗或将成为难治性疾病的重要选择,让更多患者拥有战胜疾病的新武器。