
神经发育障碍影响全球约15%的儿童和青少年,常导致认知、社交与运动功能受损。其中,神经管缺陷(如无脑畸形)与皮层发育异常等疾病,可追溯至胚胎早期神经管闭合过程的异常。神经管闭合是大脑与脊髓发育的关键事件,该过程高度依赖机械力的精确调控,包括顶端收缩、细胞间张力建立与细胞极性形成。同时,Hippo、Wnt等经典形态发生信号通路也参与其中。然而,机械信号如何与生化信号协同调控神经管发育,其分子机制尚不明确。
既往研究表明,Hippo通路的核心效应因子YAP在维持组织稳态及调控衰老过程中发挥重要作用(PMID: 30933975,PMID: 38577810)。那么,在胚胎发育的起始阶段——尤其是神经管形态发生过程中,YAP是否也承担关键角色?为回答这一问题,研究团队将目光聚焦于生命发育的源头。
近日,Science China Life Sciences(《中国科学:生命科学》英文版)在线发表中国科学院动物研究所刘光慧研究员团队、首都医科大学宣武医院王思研究员团队和中国科学院动物研究所曲静研究员团队合作题为“Mechanosensor YAP Orchestrates Human Neural Rosette Morphogenesis via TEAD4–LEF1 Transcriptional Nexus”的研究论文。该研究从机械生物学与转录调控的交叉视角,系统揭示了YAP作为机械传感器在人类神经管形态发生中的核心作用,并提出了“YAP–TEAD4–LEF1”调控轴线作为神经管缺陷(如无脑畸形)潜在干预靶点的重要意义。
研究人员利用人皮质类器官模型,发现YAP在早期神经花环结构的高张力顶端区域富集并发生核转位,提示其响应局部力学微环境。为进一步验证其功能,研究团队通过CRISPR/Cas9技术构建了YAP敲除的人胚胎干细胞,并分化为皮质类器官。结果显示,YAP缺失导致神经干/祖细胞顶端-基底极性严重破坏,表现为细胞骨架紊乱、紧密连接蛋白ZO-1分布异常、纤毛发生受损,最终导致神经花环结构无法正常形成。
为进一步揭示其调控机制,研究人员整合单细胞核RNA测序与染色质可及性测序数据,发现YAP缺失后,神经干细胞在转录组与表观基因组层面出现最显著扰动。功能富集分析表明,与细胞连接组装、Wnt信号通路等关键过程相关的基因显著下调,其中Wnt通路核心转录因子LEF1的表达及其启动子区域的染色质开放程度同步下降。多组学数据共同提示,LEF1是YAP下游的关键效应基因。后续实验证实,YAP与TEAD4形成转录复合体,直接结合于LEF1启动子区域并激活其转录。功能回复实验表明,LEF1敲低可模拟YAP缺失导致的神经花环缺陷,而其过表达则能部分挽救YAP缺失引起的顶端极性与结构异常。
该研究首次在人类皮质类器官模型中揭示了“YAP–TEAD4–LEF1”轴线在神经管形态发生中的核心作用,阐明了机械力信号通过Hippo通路与Wnt通路交叉对话调控神经发育的分子机制,为理解神经管缺陷的发病机制提供了新视角,并为相关疾病的早期诊断、遗传咨询及靶向干预策略开发奠定了理论基础。
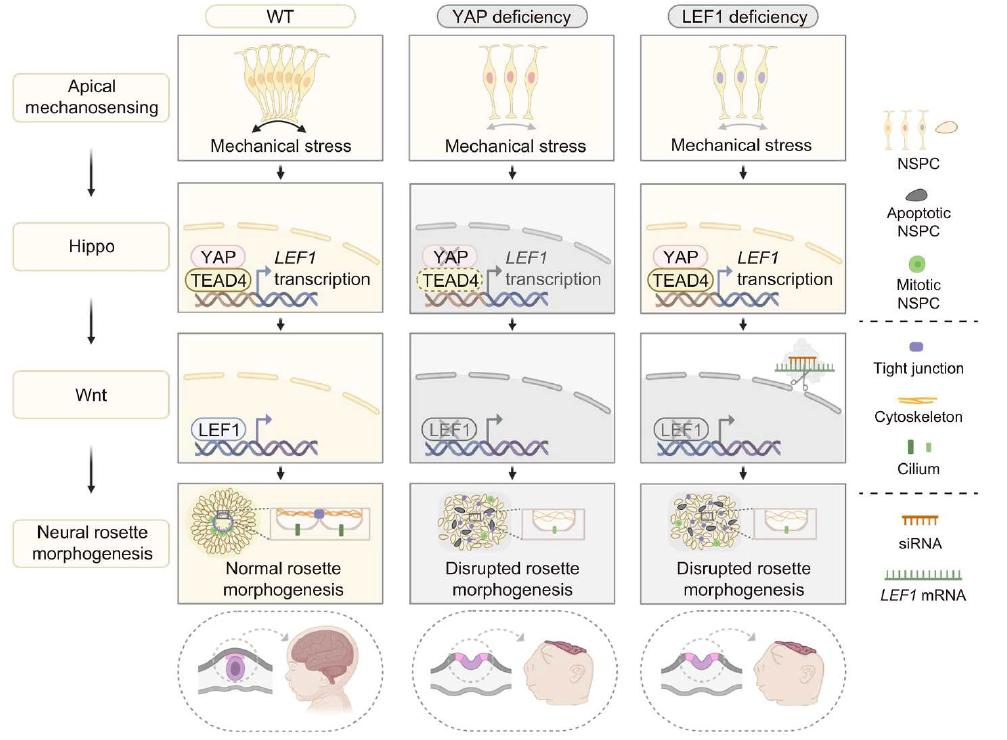
YAP基因缺陷与LEF1基因缺陷导致神经花环结构形态发生异常的通路机制示意图