
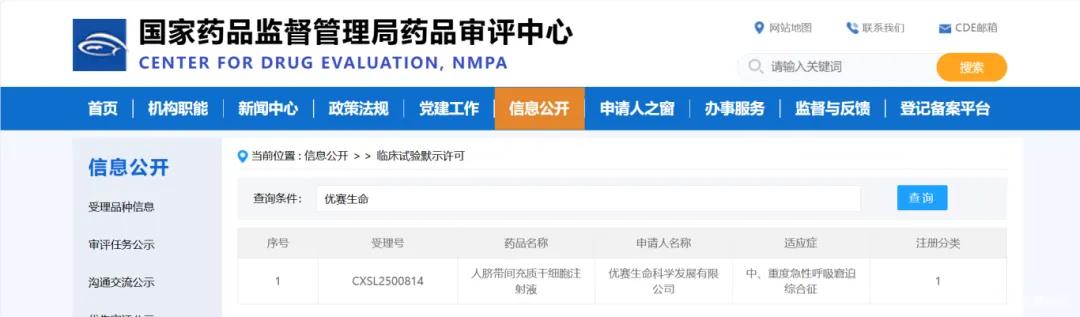
12月17日,优赛生命科学发展有限公司此前在国家药品监督管理局药品审评中心获受理的干细胞药物已经成功获得临床试验默示许可,进入药物申报重要阶段。
此次干细胞药物的适应症为:中、重度急性呼吸窘迫综合征。是一种以弥漫性炎症性肺泡及肺毛细血管损伤和快速发作性低氧血症为特征的临床综合征,是重症患者中最为常见的临床综合征之一。此前在新冠重症集中爆发阶段,优赛生命制备的脐带间充质干细胞制剂在天津以及外阜十几家医疗机构ICU内紧急使用;应用患者30余例,肺部CT影像100%改善,使用次日Crp下降、血氧明显上升,这也为本次的药物申报项目提供了十足的经验与信心。

2025年以来,国家相继出台多项支持生物医药产业发展的政策举措,特别是国务院818号条例,为细胞治疗领域创造了前所未有的发展环境。这一具有里程碑意义的政策创新性地建立了"临床研究备案制+临床转化应用审批制"双轨监管模式,为优赛生命这种生产型创新企业开辟了绿色通道。条例特别强调对罕见病、危重症治疗技术的优先支持,与优赛生命干细胞新药针对的中、重度急性呼吸窘迫综合征这种适应症高度契合,为企业研发提供了前所未有的政策保障。

天津自贸试验区2025年11月发布的《基因与细胞治疗新技术临床研究和临床转化应用分类分级标准规范(试行)》作为全国首个地方实施细则,通过科学分类分级实现了精准监管。该规范将干细胞治疗技术依据风险等级划分为高、中、低三级,为细胞技术提供了加速转化通道。作为天津细胞谷的核心参与单位,优赛生命研发进程显著提速,2026年1季度起优赛生命计划增项申报针对肝衰竭、急性缺血型脑卒中的干细胞IND项目。优赛生命始终紧跟政策指引,深耕干细胞研究与转化,此次新药成功获得临床默示许可,正是政策赋能与企业创新实力完美结合的生动体现。

站在这个新的起点上,优赛生命将继续秉持创新精神,依托政策支持,加速推进干细胞药物的研发与转化。我们深知,每一个科研突破的背后,都寄托着无数患者对健康的渴望。优赛生命将始终坚持"去芜存菁,臻于至善"的理念,以更高的标准、更严的要求推进后续临床研究工作,力争早日为更多患者带来更好的治疗选择。
关于我们
优赛生命科学发展有限公司是一家国家级高新技术企业,荣获天津市专精特新中小企业等资质认定。作为天津细胞谷核心参与单位、细胞生态海河实验室、天津市细胞与基因治疗创新联合体,入选国家工信部京津冀生命健康产业集群。通过考核建立了博士后科研工作站。
临床项目介绍
*2025年10月,优赛生命科学发展有限公司联合参与山东省重点研发计划(国际科技合作)项目,聚焦重症肝病治疗领域的前沿研究。( 项目编号:2025KJHZ016)
*2025年9月,优赛生命科学发展有限公司首款干细胞药物获得国家药品监督管理局药品审评中心受理,适应症为中、重度急性呼吸窘迫综合征。
*2024年4月,优赛生命和中国人民解放军总医院王福生院士团队合作的肿瘤浸润淋巴细胞治疗肝癌晚期项目进入临床试验阶段,治疗总有效率达到60%,并于2025年6月顺利通过北京科委结题验收。
*2025年6月,优赛生命和中国医学科学院血液病医院开展的“评价异体脐带来源间充质干细胞治疗CAR-T后长期血细胞减少的血液系统恶性肿瘤患者的安全性及有效性的单臂、探索性临床研究”已正式启动并入组患者。
*2024年5月,优赛生命和南开大学开展的“建立脂肪干细胞分化为胰岛素分泌细胞的体外快速诱导方案”临床研究项目正式启动。
*2024年6月,优赛生命和中科先进院的天津院和深圳院合作干细胞治疗肝硬化项目(《京津冀间充质干细胞临床协同创新项目》)。
*2024年7月,优赛生命的核心干细胞产品“人脐带间充质干细胞”制剂通过中国食品药品检定研究院(以下简称“中检院”)的质量复核检验,正式获得中检院颁发的《检验报告》(报告编号分别为:SH202410741、SH202410761、SH202407721、SH202410781)
*2023年7月起,优赛生命相关干细胞治疗急性间质性肺炎药物申报进行当中,预计今年末明年初进入临床实验。
*2022年底到2023年初新冠重症集中爆发阶段,优赛生命制备的脐带间充质干细胞制剂在天津以及外阜十几家医疗机构ICU内紧急使用;应用患者30余例,肺部CT影像100%改善,使用次日Crp下降、血氧明显上升。部分患者首次使用后可以调整呼吸机模式,第二次应用后可以进行呼吸机脱机,挽救了许多患者的生命。