近年来,免疫疗法的兴起为癌症治疗带来了新的曙光。T细胞能识别并杀死癌细胞,过继细胞疗法(ACT)便是利用了T细胞的细胞毒性能力来消灭肿瘤。其中T细胞受体工程化T细胞(TCR-T)疗法通过基因工程技术改造患者自身的T细胞,使其能够精准识别并攻击肿瘤细胞,在治疗实体瘤方面展现出潜力。
关于TCR-T细胞疗法
TCR-T细胞疗法与CAR-T疗法类似,两者都是从患者体内提取T细胞,在实验室增强并扩增后,回输到患者体内便会实现杀伤肿瘤的目的。
多数情况下,癌细胞能逃避免疫疗法的追踪,因为它们的识别标志物隐藏在细胞内部而非表面。这就导致CAR-T细胞疗法可能无法有效识别癌细胞。而T细胞受体工程化T细胞(TCR-T)疗法则能够识别癌细胞内部标志物的免疫细胞来实现精准打击。
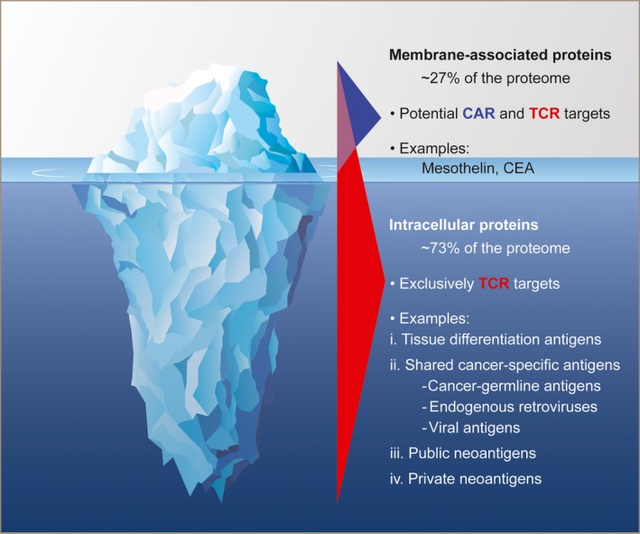
与CAR相比,TCR识别的抗原数量更大。
知识窗口:三大T细胞疗法优劣一览
嵌合抗原受体T细胞疗法(CAR-T疗法)
T细胞受体工程化T细胞疗法(TCR-T疗法)
肿瘤浸润淋巴细胞疗法(TIL疗法)
优势:
1.治疗方法不受HLA类型限制
2.不需要抗原呈递机制
3.制造时间比TIL短
4.不需要手术
优势:
1.靶向不受抗原定位限制
2.制造时间比TIL短
3.不需要手术
优势:
1.多抗原靶向潜力
2.抗原靶向无需预先明确界定
3.靶向不受抗原定位限制
劣势:
1.靶向限于膜锚定蛋白的细胞外域(有一些例外)
2.需要明确的靶抗原
3.可能因靶抗原表面表达缺失而失效
4.通常仅靶向单一抗原(存在少数例外)
劣势:
1.治疗受人类白细胞抗原(HLA)类型限制
2.可能因靶抗原表面表达缺失而失效
3.需要明确的靶抗原
4.通常仅靶向单一抗原
劣势:
1.不同细胞产品的抗原靶向特异性差异很大
2.需要进行手术获取肿瘤组织
3.制造时间比CAR-T、TCR-T长
识别能力的区别
如果说CAR-T细胞是只能识别细胞表面敌人的“哨兵”,那么TCR-T细胞就是能够深入敌营、进行“内部侦查”的特种部队。
识别目标不同:CAR-T细胞靶向的是细胞表面的抗原;而TCR-T细胞则能识别由细胞内部产生、并呈递到细胞表面的多肽-主要组织相容性复合物。这意味着,TCR-T能够探测到源于癌细胞内部突变蛋白的信号,从而将藏匿于内部的癌细胞揪出。
精准度与潜力:这一机制使得TCR-T疗法能够靶向更多样、更特异的癌症靶点,尤其是那些驱动癌症发生、发展的核心驱动突变。这对于治疗诸如黑色素瘤、肉瘤等实体瘤具有巨大潜力。
透视癌细胞内部:TCR-T的精准打击术
正如MSK的癌症专家Dr. Klebanoff所述:“这虽不完全是X光透视眼,但已非常接近。”经过二十多年的深入研究,Dr. Klebanoff指出,要让免疫疗法惠及更广泛的患者,必须克服三大核心障碍,而TCR-T疗法恰恰提供了可行的解决方案:
寻找真正癌特异性的靶点
理想的疗法应该像一只训练有素的警犬,只攻击癌症细胞而不伤害健康细胞。通过靶向癌细胞内部独有的突变蛋白(如癌症抗原),TCR-T有望实现极高的精准度,避免“误伤友军”造成的严重副作用。
寻找肿瘤内所有细胞共享的靶点
肿瘤内部并非铁板一块,而是充满异质性。TCR-T若靶向存在于所有肿瘤细胞中的驱动突变,就能实现对癌细胞的“一网打尽”,防止残留细胞死灰复燃。
寻找肿瘤无法丢弃的靶点
肿瘤中的一些突变是疾病发展的驱动因素,而另一些只是随波逐流而已。癌细胞可以轻易地摆脱这些突变,同时不会丧失其致癌能力。但驱动其恶性增殖的驱动突变是其生存的根本,难以丢弃。靶向这类靶点,可有效防止肿瘤通过变异产生耐药性。
这一机制使TCR-T疗法在治疗实体瘤方面具有独特优势。全球临床实验分析显示,TCR-T疗法在多种难治性实体肿瘤中均表现出显著疗效。
靶向MAGEA1:IMA202疗法的早期成功
2024年7月,美国MD安德森癌症研究中心以及德国汉堡大学附属埃彭多夫医院等多位研究人员在《Journal forImmunoTherapy of Cancer》发表了抗MAGEA1自体TCR转基因T细胞疗法在MAGEA1阳性复发性和难治性实体瘤中的临床安全性和疗效的首次人体剂量递增试验结果。

IMA202是一款靶向MAGEA1的TCR-T细胞疗法。MAGEA1是一种典型的“癌睾抗原”,它在多种实体瘤(如黑色素瘤、肝癌、肺癌等)中广泛表达,但在正常成人组织中(除睾丸外)几乎不表达。这种表达模式使其成为理想的免疫治疗靶点,能最大限度地避免“误伤”正常组织。
这项1期试验(IMA202-101)共16名患者接受IMA202治疗,7名患者患有黑色素瘤,2名肛门鳞状细胞癌(SCC),2名肝细胞癌,2名非小细胞肺癌(NSCLC),以及骨肉瘤、横纹肌肉瘤和口咽鳞状细胞癌患者各1例。结果显示:11名(68.8%)患者的最佳总体反应是疾病稳定(SD),5名患者的靶病灶总和出现初始肿瘤缩小。其中患者03在第42天评估为病情稳定(SD),在3个月时其靶病灶直径总和进一步缩小了35.4%。
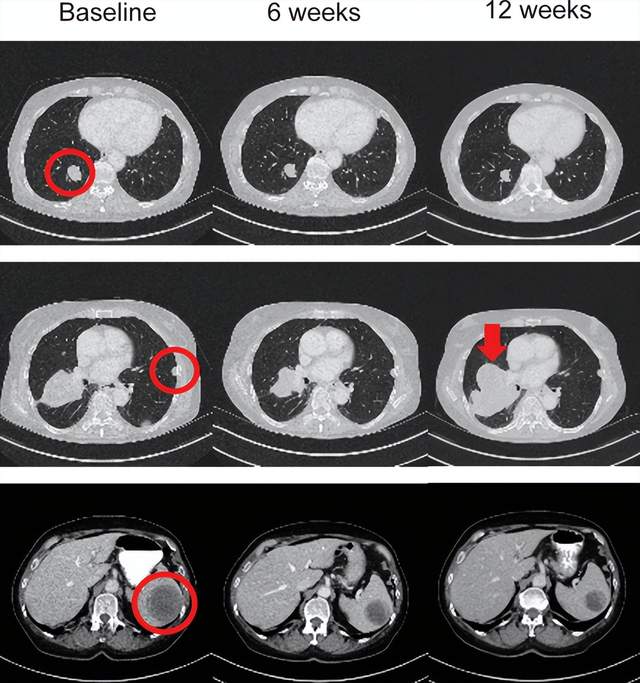
因此,IMA202在MAGEA1阳性复发性和难治性实体瘤中具有一定的临床效果。
多方突破:肺癌、结直肠癌患者的希望之光
2022年,Alaunos公司公布了其正在进行的TCR-T细胞疗法1/2期临床试验的早期数据。该试验招募了非小细胞肺癌、结直肠癌、子宫内膜癌、胰腺癌、卵巢癌和胆管癌患者。
其中一名非小细胞肺癌患者曾接受多线治疗,且对免疫检查点抑制剂耐药。经过TCR-T细胞治疗后,该患者部分缓解,生存期六个月无进展。

另一名结直肠癌患者既往仅接受过一线治疗,TCR-T细胞治疗后盆腔肿块缩小,所有靶病灶总体减少。
这些早期数据令人鼓舞,虽然最后患者病情进展,但仍旧显示了TCR-T疗法在对既往治疗无反应的患者中具有客观的临床反应。
潜力无限:疗效数据彰显广阔前景
2022年9月,《IMMUNO-ONCOLOGY AND TECHNOLOGY》发表了荷兰癌症研究所进行的I/IIa期试验(NCT02654821)结果。研究人员开发了一种用MART-1特异性TCR转导的自体外周血衍生T细胞(1D3HMCys),12例黑色素瘤患者接受了1D3HMCys T细胞治疗。
结果显示:11例可评估的患者中有2例达到客观部分缓解,另外5例患者观察到轻微的肿瘤缩小。
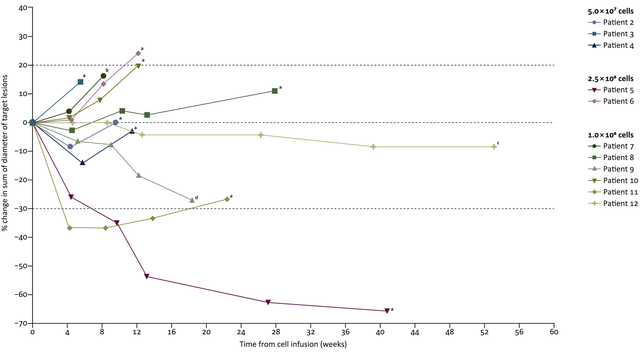
患者5在细胞输注9.5周后达到部分缓解(PR),反应持续时间为7.1个月。

综上可见,TCR-T细胞疗法展现出了作为潜在癌症治疗的潜力。
结语
TCR-T细胞疗法作为一种新兴的癌症免疫治疗方法,具有巨大的潜力和广阔的应用前景。随着科学家们不断探索新的技术和方法,TCR-T细胞疗法将会得到进一步优化。未来有望成为癌症治疗的主流方法之一,为人类战胜癌症做出重要贡献。