不少乳腺癌觅友拿到病理报告后,常因内容复杂感到困惑。在最新一期【觅友・曼曼聊】直播中,大连医科大学附属第二医院乳腺肿瘤科李曼教授与病理科王齐敏教授携手,从临床与病理双重视角切入,助力大家深入读懂报告中的核心指标与关键信息。
在文章开始之前,姐妹们也可以先点击预约下期的直播哦!
01
医心为你
Q1
李曼教授:当乳腺癌患者拿到乳腺癌病理报告时,上面有哪些关键指标需要注意?
王齐敏教授:拿到乳腺癌病理报告,不少人因满篇专业术语感到迷茫,可这份报告却是医生判断病情、制定治疗方案的关键依据。
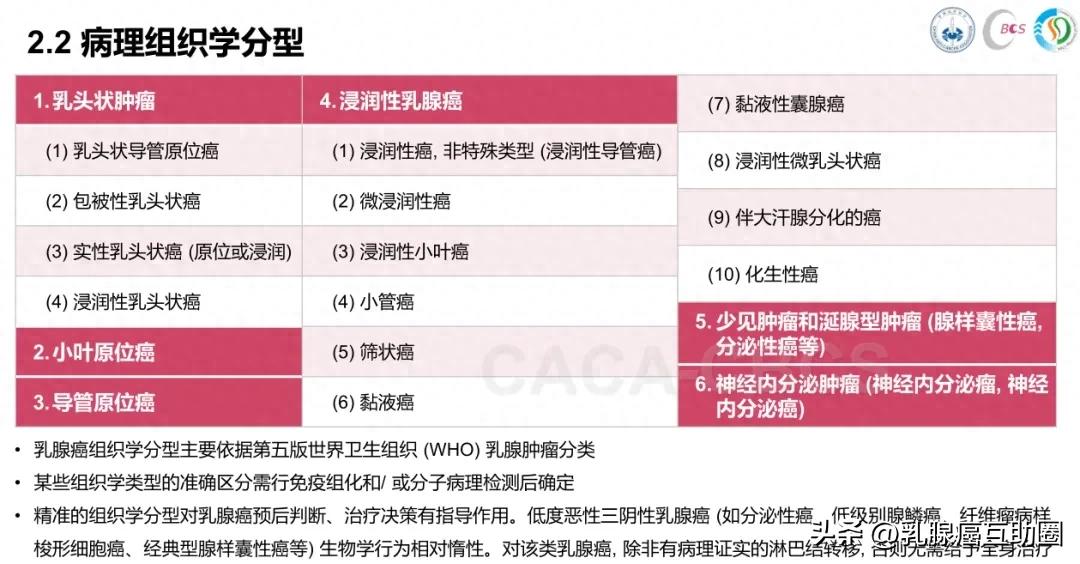
报告首先明确的是肿瘤病理组织学类型,最常见的是“非特殊型浸润性乳腺癌”(曾称 “浸润性导管癌”),另有小管癌、筛状癌等十几种“特殊型”乳腺癌,这类肿瘤生长慢、侵袭性低,预后较好;而浸润性微乳头状癌易与血管或淋巴管结构混淆,复发转移风险高,预后稍差。
图源:CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)
诺丁汉分级也很重要,通过观察肿瘤细胞形态、排列和分裂情况,分为1-3级,级别越高,癌细胞越“活跃”、生长越快,需更积极治疗。
同时,报告还会说明肿瘤大小、浸润范围,以及是否存在原位癌成分(癌变未突破基底膜)、脉管内癌栓(关系转移风险)。
最关键的是 ER(雌激素受体)、PR(孕激素受体)、HER-2(人表皮生长因子受体2)、Ki-67(反映细胞增殖速度)这几项免疫组化检测指标,它们是乳腺癌分子分型的基础,直接决定后续是否需内分泌、靶向或化疗。

图源:CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)
Q2
李曼教授:病理报告中的Ki-67是什么?对于乳腺癌治疗有何意义?
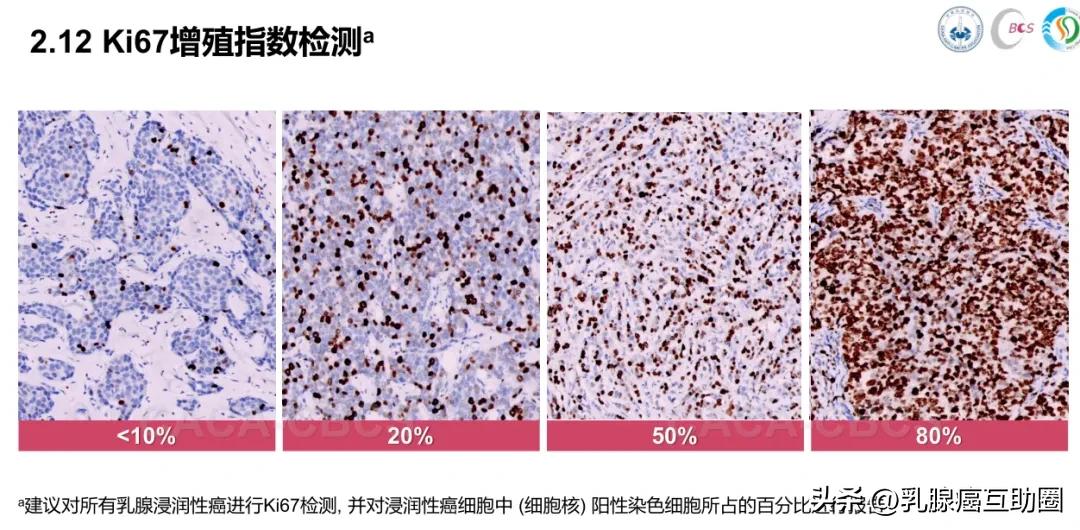
王齐敏教授:病理科医生会在显微镜下找肿瘤细胞增殖“热点区”,计算表达Ki-67的癌细胞百分比。
多数乳腺癌患者Ki-67指数在5%-30%,低于5%提示肿瘤增殖慢、预后好;≥30%则说明肿瘤生长活跃、复发风险高、预后较差。
较高Ki-67值会提示医生采取更积极治疗和密切随访,但Ki-67并非唯一判断标准,需结合 ER、PR、HER-2状态及肿瘤大小、淋巴结情况等综合评估病情。
图源:CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)
Q3
李曼教授:病理报告中的ER、PR、HER-2又是指什么?
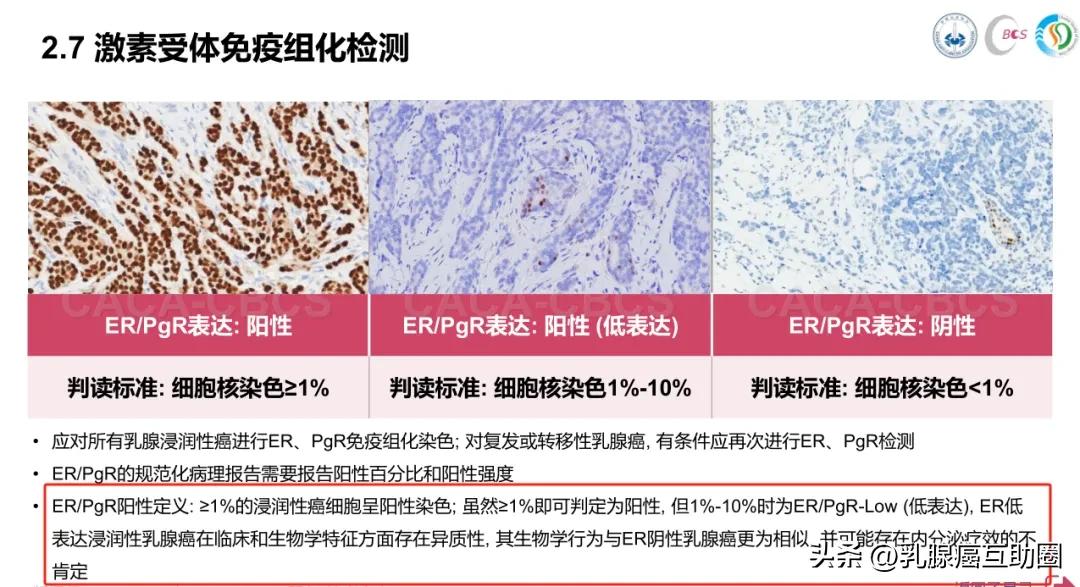
王齐敏教授:简单来说,ER和PR分别代表癌细胞是否“接受”雌激素和孕激素的信号。如果检测结果显示ER或PR阳性,当其表达≥10%,说明这些癌细胞的生长受到体内雌、孕激素的“刺激”更容易增殖。
图源:CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)
这类患者的一大优势在于:可以接受内分泌治疗。通过药物降低体内激素水平或阻断激素对癌细胞的作用,就能有效抑制肿瘤生长,显著降低复发和转移的风险。因此,ER/PR阳性意味着治疗手段更多,预后通常也相对较好。
除了激素受体(ER、PR),HER-2(人类表皮生长因子受体2)也是一个关键指标。当HER-2高表达或基因发生扩增时,意味着癌细胞中存在一种“加速器”,促使肿瘤快速生长。但现代医学已研发出针对HER-2的靶向药物(如曲妥珠单抗等),能有效控制病情。
总的来说,上述四项指标并非孤立存在,而是共同决定了乳腺癌的分子分型,医生依此为患者定制含手术、化疗、内分泌治疗、靶向治疗等在内的个体化方案。
Q4
李曼教授:病理报告中的脉管癌栓是什么?是提示肿瘤复发转移了吗?
王齐敏教授:癌细胞可经血液、淋巴系统扩散,病理检查若发现血管或淋巴管内“脉管内癌栓”需明确标注。虽人体免疫可能清除部分癌细胞,但癌栓提示癌细胞侵袭力强、进入脉管里,属高风险因素,会增加转移可能。

图源:CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)
举个例子,在我接诊的一位患者中,病理诊断为“非特殊型浸润性导管癌(二级)”,从分级来看属于中等分化程度,预后通常相对可控。
但令人关注的是,其肿瘤组织中存在广泛的脉管内癌栓,这意味着癌细胞活跃、易于侵入脉管系统。最终,这位患者出现了多发淋巴结转移,病情进展较快。这也说明,脉管癌栓的存在,是评估复发和转移风险的重要依据之一。
因此,虽然发现脉管癌栓并不等于已经发生转移,但却是风险警示,医生会据此建议更积极治疗或加强随访。
Q5
李曼教授:那病理报告提示淋巴结转移,对乳腺癌的治疗及预后有何影响?
王齐敏教授:乳腺癌诊疗中,淋巴结是否转移至关重要,直接影响疾病分期与后续治疗。手术常用前哨淋巴结活检,术中取淋巴结快速检测,判断是否需进一步清扫腋窝淋巴结,兼顾疗效与减少并发症。
随着医学研究深入,淋巴结转移分类更精细,除传统“宏转移”(肉眼或常规镜检可见的较大范围转移)外,还包括“微转移”和“孤立肿瘤细胞转移”,这类更早期、更微小的转移形式,分类依据是淋巴结内癌细胞数量与病灶大小。分期上,转移淋巴结≤3枚为N1期,大于3枚则为N2期及以上。

图源:CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)
这种精确分期能帮助医生科学评估病情严重程度,进而制定个体化治疗策略,如是否开展化疗、放疗或靶向治疗。因此,淋巴结评估不仅是乳腺癌分期的重要依据,更是决定患者预后与治疗方向的关键一步。
02
一问医答
Q6
李曼教授:患者乳腺结节穿刺术后病理结果为luminal A 型早期乳腺癌,全乳房切除术后分子分型由 luminal A 型转变为三阴型,究竟哪一份病理报告更具可信度?
王齐敏教授:乳腺癌诊断中,穿刺病理与术后大病理在组织学类型、免疫组化结果及分子分型上可能存在差异,主要源于两方面:
①组织样本局限性:穿刺样本仅为肿物一小部分,难呈现全貌,检测结果不够全面,而术后大标本能提供更多组织,更准确评估肿瘤生物学特性;
②免疫组化复杂性:Luminal 分型及 PR、HER-2、Ki-67等指标需兼顾表达强弱与比例,穿刺样本肿瘤细胞少,判断有局限,术后大标本依据更可靠,通常以其结果为准。
确诊三阴性乳腺癌(ER、PR、HER-2均阴性)需注意:
①乳腺癌异质性高:不同区域癌细胞分子特征可能不同,初诊三阴性也可能混杂其他类型癌细胞;
②出现结果不一致时:病理医生需复查切片,必要时补充检测,还建议多学科团队协作,确保诊断准确并制定最佳治疗方案。
Q7
李曼教授:活检穿刺提示HER-2为”0“,术后的大病理检测显示HER-2(2+),为什么会有这样的变化?
王齐敏教授:乳腺癌诊断中,穿刺活检与术后大标本检测常现结果不一致,如HER-2或激素受体表达变化,核心原因是肿瘤异质性—— 肿瘤内部不均,不同区域癌细胞形态、生长速度及分子特征有差异。
以HER-2检测为例,其免疫组化判读需结合染色强度与阳性细胞比例,其关键分界值为10%:
①超10%肿瘤细胞呈中等或弱完整细胞膜染色才判为HER-2(2+);
②如果细胞膜染色微弱、不完整则可能归为HER-2(1+)或HER-2为“0”。
因异质性,穿刺若取到 HER-2低表达区域易现“假阴性”,而术后全面评估整块肿瘤,更易发现高表达区域,从而修正判读。

图源:CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)
Q8
李曼教授:临床当中看到很多的患者在手术的时候发现HER-2(1+),经过了十年或者是五年出现了复发和转移,而这时免疫组化从原来的HER-2是0或者HER-2(1+)转化为了HER-2(3+),这是为什么?
王齐敏教授:肿瘤细胞群体由遗传特征有差异的“亚克隆”组成,类似大家族不同分支。肿瘤初形成时,HER-2高表达的亚克隆可能仅少数,在整体中不占优势,因此初次检测常显示HER-2低表达或阴性。
随着疾病进展,或经化疗、内分泌治疗后,原本占优势的癌细胞可能被清除,而数量少但生存能力强的HER-2高表达亚克隆会被“筛选”出来,逐渐成为主导,这就导致部分患者复发时HER-2状态“升级”。
反之,HER-2强阳性患者接受抗HER-2靶向治疗后,HER-2高表达癌细胞被抑制,不依赖HER-2通路的亚克隆会趁机“上位”,使HER-2表达下降甚至转阴。
因肿瘤能根据药物、免疫环境等外界压力调整生存策略,所以疾病复发或转移时,需对转移灶再次穿刺活检,重新评估ER、PR、HER-2、Ki-67等指标,帮助医生掌握肿瘤的现状情况,进而调整治疗方案。

图源:CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)
03
写在最后
乳腺癌病理报告是制定治疗方案的“指南针”,希望通过本期【觅友·曼曼聊】的直播,大家能对自己的病情更了解,在抗癌路上走得更稳、更远、更好~

本文审核专家:李曼教授

本文审核专家:王齐敏教授
温馨提醒:文章旨在传递疾病知识,不作为诊疗方案推荐及医疗依据。
封面图片来源:稿定设计
责任编辑:觅健小狮