作为免疫调控领域的经典细胞因子,IL-12 凭借强大的抗肿瘤免疫激活能力,成为肿瘤免疫治疗的热门靶点。但长期以来,剂量限制性的全身毒性让其临床应用屡屡受阻,成为横亘在研发路上的最大瓶颈。如今,随着靶向递送技术的不断突破,IL-12 的局部递送效率大幅提升,全身毒性显著降低,多款改良型 IL-12 药物在临床前和临床试验中展现出惊艳疗效,同时其在自身免疫性疾病中的调控作用也被不断挖掘,为多类疾病的治疗开辟了新路径。本文将从结构、调控、功能、药物开发到临床应用,全方位深度剖析 IL-12 的研发与应用现状。
01 IL-12 结构概述:异二聚体结构奠定免疫调控核心基础IL-12 隶属于 IL-12 细胞因子家族,该家族还包括 IL-23、IL-27、IL-35 等成员,虽各成员结构与功能各异,但均是免疫平衡的关键调控者,直接影响疾病的发生与发展。
作为家族核心成员,IL-12 是由p35 和 p40 亚基组成的异二聚体活性分子(p70),两个亚基的编码基因分别位于 3 号和 5 号染色体,只有二者共表达才能形成具有生物活性的 IL-12。其发挥功能的前提是与靶细胞表面的特异性受体结合,IL-12 受体由 IL-12Rβ1 和 IL-12Rβ2 两个跨膜蛋白组成,前者与 IL-12p40 结合、后者与 IL-12p35 结合,二者共同构成完整的信号传导受体。
IL-12 主要由淋巴细胞、巨噬细胞、树突状细胞等抗原呈递细胞产生,而其受体主要表达在 NK 细胞和 T 细胞表面,二者结合后可激活下游多条信号通路,一方面促进 Th1 细胞分化、增强 CTL 细胞和 NK 细胞的杀伤活性,另一方面激活 B 细胞、调节肿瘤微环境,成为连接先天免疫和适应性免疫的核心桥梁。
02 IL-12 的表达调控:精密调控网络决定其免疫功能发挥IL-12 的产生与活性并非无序释放,而是受多层面、多通路的精密调控,从合成、信号转导到转录翻译、分泌,每一步都有严格的调控机制,同时还存在正负调控因子的相互制衡,确保其在免疫反应中精准发挥作用。
产生与信号转导:IL-12 主要由抗原呈递细胞在抗原刺激下合成,其产生受 TNF-α、IL-1β、IFN-γ 等免疫信号调控,形成正反馈回路启动适应性免疫;相关信号通路包括 TLR、CLR、JAK-STAT、PI3K/Akt 等,其中 JAK-STAT 是其发挥功能的核心通路,可促进 Th1 细胞分化和 IFN-γ 产生,PI3K/Akt 则对 IL-12 产生起双重调节作用,平衡炎症反应。
转录翻译与分泌:转录阶段,NF-κB、AP-1 等转录因子结合到 IL-12 启动子上促进转录,共转录因子通过表观遗传修饰增强转录效率;翻译阶段,RNA 结合蛋白、mTOR 等调控 mRNA 稳定性和翻译效率;分泌阶段,IL-12 亚基经内质网、高尔基体修饰后通过囊泡分泌至细胞外,该过程受细胞因子和细胞间相互作用调控。
正负因子制衡:负调控因子通过抑制 IL-12 产生、阻断信号传导等方式降低其活性,正调控因子则通过激活信号通路、促进转录等方式增强其免疫作用,二者的动态平衡让 IL-12 既能有效启动免疫反应,又能避免炎症过度激活。
03 IL-12 的病理学功能及免疫治疗:抗肿瘤潜力巨大,毒性成临床瓶颈IL-12 是免疫调控的 “多面手”,在抗肿瘤免疫中发挥核心作用,但其剂量限制性毒性成为临床应用的最大障碍,也推动了各类改良策略的研发。
核心抗肿瘤功能:激活免疫细胞 + 重塑肿瘤微环境IL-12 的抗肿瘤作用主要体现在两个方面:一是全方位激活免疫细胞,促进 Th1 细胞增殖、增强 NK 细胞和 CTL 细胞的细胞毒性,提高巨噬细胞吞噬能力,还能促进 IFN-γ、颗粒酶分泌,直接诱导癌细胞凋亡;二是重塑肿瘤微环境,抑制 Treg 细胞的免疫抑制作用,下调 CD8+T 细胞的 PD-1 表达,保护肿瘤浸润 T 细胞免受凋亡,逆转肿瘤免疫抑制状态,增强抗肿瘤免疫反应。
临床最大障碍:剂量限制性全身毒性尽管抗肿瘤潜力显著,但全身使用 IL-12 会引发严重的免疫相关不良事件(irAE),且具有剂量限制性,主要包括血液学毒性、肝毒性、流感样症状等,这些毒性反应限制了其临床给药剂量,大幅降低了治疗窗口,也是早期 IL-12 药物人体试验效果不佳的核心原因。
改进核心思路:局部靶向递送,降低全身毒性针对毒性问题,研发的核心改进策略是局部持续递送 IL-12,通过增强其在肿瘤微环境中的时空分布,实现 “肿瘤局部高浓度、全身低浓度”,既保证抗肿瘤疗效,又显著降低全身毒性,同时还能诱导全身抗肿瘤免疫、减少 T 细胞负调控,为 IL-12 的临床应用带来新希望。
04 IL-12 的药物开发及递送策略:多技术路线齐发力,突破递送难题为实现 IL-12 的靶向递送,研发人员开发了多种药物改造和递送技术,涵盖蛋白质工程、细胞递送、病毒递送、非病毒递送、核酸递送五大方向,各技术路线各有优势,均在临床前或临床试验中展现出良好的应用前景。
蛋白质工程:改造 IL-12 分子,提升肿瘤特异性通过蛋白质工程对 IL-12 进行分子改造,核心是降低全身毒性、提高对肿瘤微环境的特异性:将 IL-12 与靶向肿瘤微环境抗原的抗体融合构建免疫细胞因子,实现靶向结合;与 IgG 的 Fc 片段融合延长体内半衰期;与肿瘤蛋白酶可裂解肽连接子融合,让 IL-12 仅在肿瘤微环境中激活,降低全身暴露。
细胞递送:依托过继细胞疗法,实现肿瘤局部表达将 IL-12 整合到过继细胞疗法中,是实体瘤治疗的重要方向:通过基因修饰让 CAR-T/TCR-T 细胞表达 IL-12,提升其在实体瘤中的浸润和杀伤能力;将 IL-12 锚定在 CAR-T 细胞膜上,实现局部持续释放;此外,树突状细胞、间充质基质细胞等也可作为载体表达 IL-12,在临床前研究中展现出一定的可行性和安全性。
病毒递送:溶瘤病毒为载体,实现溶瘤 + 免疫激活双重效应单纯疱疹病毒、腺病毒、痘苗病毒等溶瘤病毒成为 IL-12 的重要递送载体,可将 IL-12 直接递送至肿瘤微环境,一方面溶瘤病毒直接裂解肿瘤细胞,另一方面 IL-12 激活局部抗肿瘤免疫,实现 “溶瘤 + 免疫” 的双重效应。通过可调控 IL-12 表达的系统还能进一步降低毒性,与免疫检查点抑制剂联合可增强疗效。
非病毒递送:低免疫原性,临床转化潜力大非病毒递送系统包括聚合物纳米颗粒、脂质纳米颗粒等化学载体,以及外泌体等生物衍生载体,其核心优势是低 免疫原性、易规模化制备,能有效将 IL-12 递送至肿瘤部位,部分制剂已进入临床试验阶段,成为靶向递送的重要发展方向。
核酸递送:裸质粒 / RNA 递送,实现 IL-12 原位表达核酸递送包括裸质粒、电穿孔介导的基因递送、mRNA 递送等方式,能让肿瘤细胞或免疫细胞原位表达 IL-12,诱导肿瘤消退和全身免疫反应,在多种肿瘤模型中取得了良好疗效,但目前仍存在转染率不稳定、表达难以调控等问题,有待进一步优化。
05 IL-12 的联合治疗方案:协同增效,大幅提升临床疗效单一治疗手段的疗效往往有限,IL-12 与传统治疗、免疫治疗、靶向治疗的联合方案,能通过不同作用机制的协同效应,大幅提升抗肿瘤疗效,成为目前 IL-12 研发的主流方向,多项联合方案已进入临床试验阶段。
联合传统治疗:化疗 / 放疗 / 手术,弥补传统治疗短板化疗、放疗虽能抑制肿瘤生长,但存在易耐药、副作用大等问题,手术难以防止肿瘤复发转移;IL-12 与化疗药物(紫杉醇、奥沙利铂等)、放疗联合,能增强抗肿瘤免疫、抑制肿瘤转移,术前局部注射 IL-12 还能降低术后复发率,在动物模型中显著延长生存期,部分联合方案已进入临床验证阶段。
联合免疫治疗:免疫检查点抑制剂为核心,激活全身免疫IL-12 与免疫检查点抑制剂(抗 PD-L1、抗 CTLA-4 抗体)的联合是目前最受关注的方案,二者能形成免疫激活的正反馈,IL-12 重塑肿瘤微环境、激活效应 T 细胞,免疫检查点抑制剂解除 T 细胞的免疫抑制,协同增强全身抗肿瘤免疫,在多种肿瘤模型和临床试验中展现出强大的抗肿瘤效果,显著提高患者生存率;此外,IL-12 与 IL-7、IL-18 等细胞因子联合,也能增强 NK 细胞和 T 细胞的功能。
联合靶向治疗:抗血管生成 + 靶向表皮生长因子,改善肿瘤微环境IL-12 与靶向 VEGF/VEGFR2 的抗血管生成药物联合,能抑制肿瘤血管生成、改善肿瘤微环境的缺氧状态,增强免疫细胞的肿瘤浸润;与西妥昔单抗、曲妥珠单抗等靶向 EGFR/HER2 的药物联合,能增强 NK 细胞介导的抗体依赖性细胞毒性,在头颈部鳞状细胞癌、乳腺癌等模型中展现出良好疗效,部分临床试验证实了其安全性和有效性。
06 IL-12 在不同疾病及模型中的作用:功能具有两面性,依疾病类型而定IL-12 的免疫调控作用并非单一的促炎或抑炎,其功能具有明显的疾病依赖性:在肿瘤中作为抗肿瘤因子,激活免疫反应抑制肿瘤生长;在多种自身免疫性疾病中作为促炎因子,推动炎症反应的发生发展,这种两面性让其成为不同疾病的差异化治疗靶点。
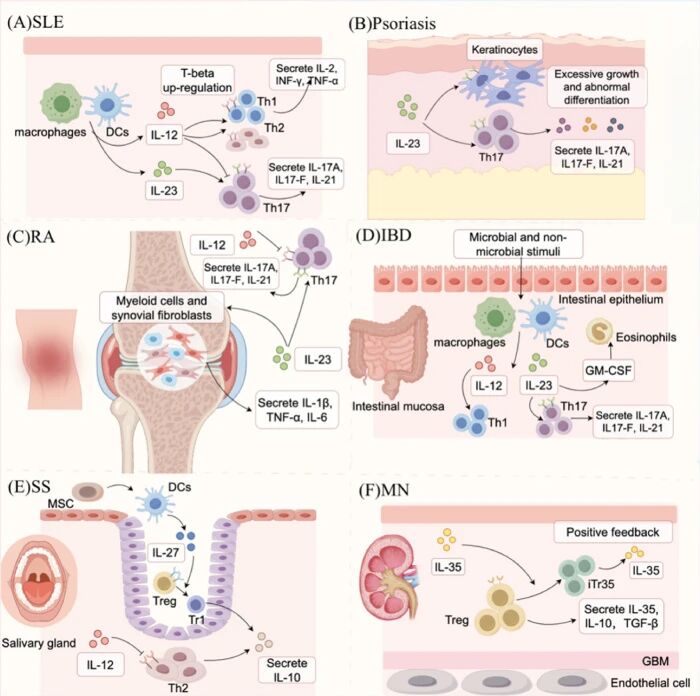
自身免疫性疾病:促炎核心因子,靶向抑制显疗效IL-12 参与了炎症性肠病、多发性硬化症、银屑病、系统性红斑狼疮、类风湿关节炎等多种自身免疫性疾病的发病机制,患者体内 IL-12 水平显著升高,相关基因多态性与疾病易感性密切相关。靶向抑制 IL-12(尤其是与 IL-23 共有的 p40 亚基)的单克隆抗体,在炎症性肠病、银屑病的临床试验中显示出显著疗效,为自身免疫性疾病的治疗提供了新方案。
癌症:抗肿瘤核心因子,靶向递送成关键如前文所述,IL-12 能通过激活免疫细胞、重塑肿瘤微环境发挥强大的抗肿瘤作用,但其全身毒性限制了临床应用。如今,随着靶向递送技术的突破,IL-12 在黑色素瘤、结直肠癌、肺癌等多种肿瘤的治疗中展现出良好前景,局部递送的 IL-12 药物能在肿瘤部位有效激活免疫,实现肿瘤消退甚至全身抗肿瘤免疫记忆。
总结与展望作为连接先天免疫和适应性免疫的核心细胞因子,IL-12 的研发历程见证了肿瘤免疫治疗从 “全身激活” 到 “精准靶向” 的发展趋势。曾经,剂量限制性毒性是 IL-12 临床应用的最大瓶颈,而如今蛋白质工程改造和靶向递送技术的不断创新,让 IL-12 的治疗窗口大幅提升,局部递送的 IL-12 药物在临床试验中展现出惊艳的抗肿瘤疗效。
同时,IL-12 的联合治疗策略也在不断丰富,与免疫检查点抑制剂、化疗、靶向治疗的协同效应,进一步挖掘了其抗肿瘤潜力,多项联合方案已进入临床中后期研究。此外,IL-12 在自身免疫性疾病中的调控作用也被不断挖掘,靶向抑制 IL-12 已成为部分自身免疫病的有效治疗手段。