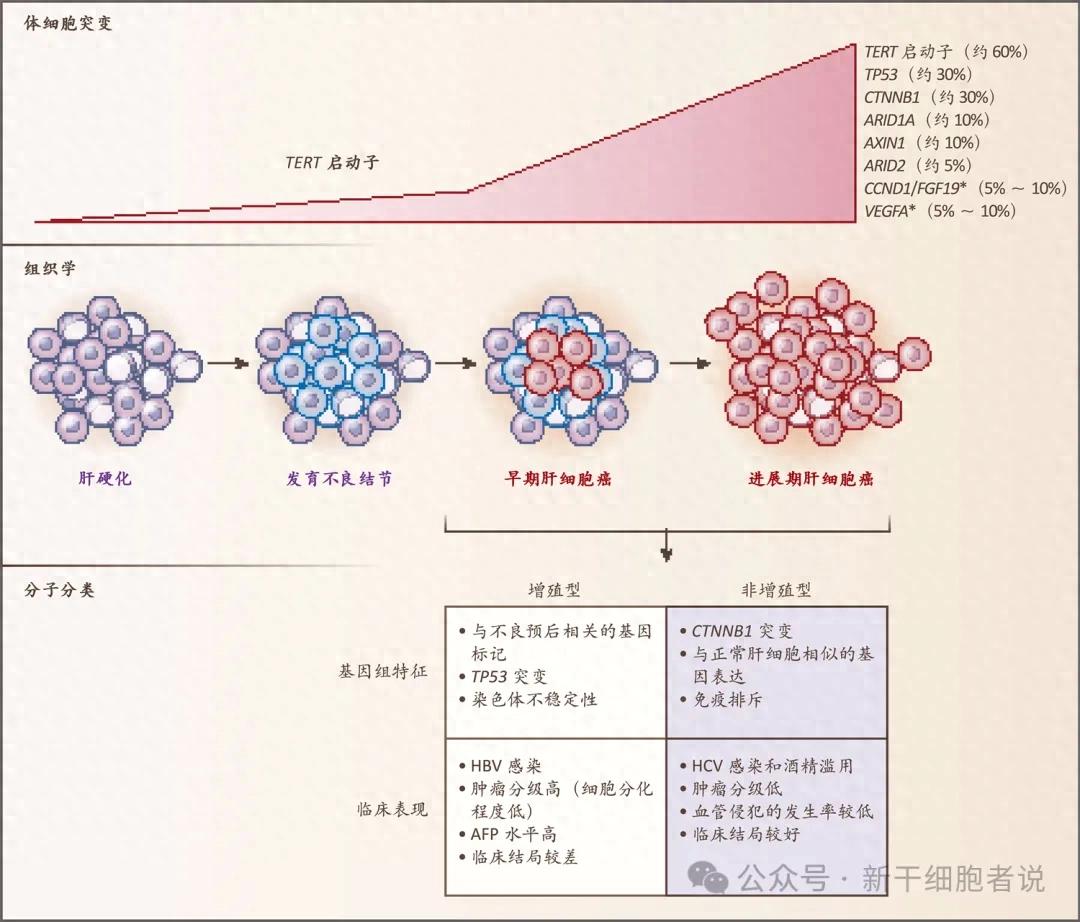
肝细胞癌
临床:
1.高危因素包括肝硬化,乙型和丙型肝炎病毒感染,乙醇、霉菌毒素(黄曲霉素等)中毒,放射线,血色素沉积症,α1-抗胰蛋白酶缺乏症等。
2.常表现为右上腹疼痛、腹水、黄疸及肝脏肿块,血清AFP常升高,偶尔出现一系列副癌综合征及伴随的生化检查异常。
大体:
1.巨块型:肿瘤呈单个巨大肿块,直径常>10cm,质地硬,切面可有出血坏死。
2.结节型:最常见,常为多个结节,直径数毫米至数厘米不等,肿瘤周围组织常为肝硬化。
3.弥漫型:肿瘤呈无数个小结节弥漫分布于肝脏中。
早期肝癌(小肝癌):单个癌结节直径<3cm或两个结节之和不超过3cm,结节界限清楚,切面常无出血及坏死。
镜下:
1.组织学结构
梁状:由3层以上细胞组成,周围围绕扁平内皮细胞,无kupffer细胞。
腺泡状:由实心细胞巢中央区域退变形成假腺样结构,腔内为胶样物(通常PAS染色阳性,黏液卡红和AB染色为阴性),其中一些腺样或腺泡样结构由癌细胞间扩张的胆小管样结构所组成。
实体型:最少见,细胞增生或受挤压形成实性细胞巢团,血窦样腔隙不明显,呈裂隙样。
2.肿瘤细胞常类似肝细胞,体积较大,多角形,核空泡状,位于中央,可有核仁。
3.分化程度
高分化:体积比正常肝细胞小,核异型轻微,细胞密度相当于正常肝脏的2倍,肝细胞索不超过3层细胞(正常结构是1层),但网状纤维支架紊乱,可有假腺样结构,脂肪变性常见。
中分化:肝细胞索宽度4个细胞以上,细胞体积较正常肝细胞大,胞质嗜酸性,圆形的核及明显的核仁,可见假腺样结构。
低分化:细胞明显异型性及多形性,核分裂易见,可见奇形的瘤巨细胞,主要呈实性分布,很少梁状结构及产生胆汁,可能有梭形细胞或小细胞区域及坏死。
vNKT细胞免疫治疗用于二线治疗后进展的晚期肝细胞癌的 单臂II期临床研究
研究疾病:vNKT细胞免疫治疗用于二线治疗后进展的晚期肝细胞癌的单臂II期临床研究
研究类型:干预性研究
研究单位:上海东方肝胆外科医院
研究阶段:II期临床试验
研究设计:单臂
研究目的:
1.主要目的: (1)评估vNKT免疫细胞治疗二线治疗后进展的晚期肝细胞癌的总体生存时间(Overall Survival, OS); (2)评估vNKT免疫细胞治疗二线治疗后进展的晚期HCC,由研究者依据实体瘤疗效评价标准1.1版(RECIST V1.1),评价的客观缓解率(Objective Response Rate, ORR)和疾病控制率(Disease Control Rate,DCR)。
2. 次要目的: (1)评估vNKT免疫细胞治疗二线治疗后进展HCC的安全性,研究者根据RECIST V1.1确定的无进展生存(Progression Free Survival, PFS)、疾病缓解持续时间(Duration of Response, DOR)、至首次疾病进展时间(Time to Progression, TTP)、至疾病缓解时间(Time to Response, TTR); (2)评估vNKT免疫细胞治疗二线治疗后进展的HCC,研究者根据mRECIST标准(mRECIST)确定的ORR、PFS、DOR、DCR、TTP、TTR。
纳入标准:
1.年龄 18-78岁,性别不限; 2.不可手术切除且不适合局部治疗,且经过一线、二线治疗后进展的晚期肝细胞癌,并且满足下列要求之一: (1)经组织学或细胞学证实诊断为HCC; (2)根据美国肝病研究学会(AASLD)标准临床确诊为HCC。不伴肝硬化的患者必须经组织学证实诊断为HCC;
2.东部肿瘤协作组体能状态评分(ECOG)为0或1;
3.预期生存期 ≥ 3个月;
4.Child-Pugh评分 ≤ 6,即Child-Pugh A;
5.受试者存在至少一个可测量病灶:根据实体瘤疗效评价标准(RECIST V1.1)进行评价;
6.器官功能水平必须符合下列要求(研究药物首次用药前7天): (1)骨髓:中性粒细胞绝对计数(ANC)≥1.5×109/L,血小板(PLT)≥ 100×109/L,血红蛋白(HB)≥9g/dL(检测前14天内未输血或接受成分血); (2)肝脏:血清总胆红素(TBIL)≤2倍正常值上限;天冬氨酸转氨酶 (AST)和丙氨酸转氨酶(ALT)≤2.5倍正常值上限; Child-Pugh A; (3)血清肌酐≤1.5倍正常值上限且内生肌酐清除率≥50mL/min (Cockcroft-Gault公式); (4)国际标准化比值(INR)、活化部分凝血活酶时间(APTT)≤1.5倍正常值上限(仅适用于未接受抗凝治疗的患者;接受抗凝治疗的患者应该使抗凝剂处于治疗要求的范围内); (5)尿蛋白≤1+,若尿蛋白>1+,需收集24小时尿蛋白测定,其总量需≤1 克; (6)心脏功能正常。即心电图检查正常或异常无临床意义、心脏超声显示左室射血分数(LVEF)大于50%;
7.育龄妇女在试验药物首次用药前7天内血清妊娠试验结果须为阴性;有生殖能力的男性或有怀孕可能性的女性,必须在整个试验过程中使用高度有效的避孕方法(如口服避孕药、宫内避孕器、节制性欲或屏障避孕法结合杀精剂),且在治疗结束后继续避孕12个月;
8.受试者自愿加入研究,签署知情同意书,依从性好,配合随访。
排除标准:
1.肝内胆管癌、纤维板层样肝癌、混合型肝细胞癌和混合型胆管细胞癌;
2.既往接受过细胞免疫治疗的患者;
3.研究药物首次用药前4周内参加了或正在参加其他药物/疗法临床试验的患者;
4.研究药物首次用药前4周内进行/接受了大型外科手术或尚未从此手术的副作用中恢复、活疫苗接种、免疫治疗,2周内进行了放疗;
5.患者正在使用免疫抑制剂、或全身激素治疗以达到免疫抑制目的(剂量>10mg/天泼尼松或其他等疗效激素),并在入组前2周内仍在继续使用的;
6.过去5年内有肝细胞癌以外其它恶性肿瘤病史,但已治愈的皮肤基底细胞癌、皮肤鳞状细胞癌、早期前列腺癌和宫颈原位癌除外;
7.活动性炎性肠病或消化道溃疡;
8.HIV抗体或梅毒螺旋体抗体检测结果阳性;
9.伴有临床症状且需要对症处理的大量胸水或腹水;
10.活动性肺部疾病(肺炎、阻塞性肺病、哮喘)或有活动性肺结核病史;
11.具有任何无法控制的临床问题,包括但不限于: (1)持续性或活动性(严重)感染; (2)药物控制不良的高血压(血压持续大于150/90mmHg); (3)控制不佳的糖尿病; (4)心脏疾病(纽约心脏学会定义的III/IV级充血性心力衰竭或心脏传导阻滞) ; (5)首次用药前6个月内出现过如下情况:深静脉血栓或肺栓塞;心肌梗死;严重或不稳定性心律失常或心绞痛;经皮冠状动脉介入治疗、急性冠脉综合征、冠状动脉旁路移植术;脑血管意外、短暂性脑缺血发作、脑栓塞;
12.患有血液系统疾病:白血病、淋巴结、骨髓增生异常综合征或骨髓瘤等;
13.除白癜风意外的免疫缺陷性疾病或自身免疫疾病;
14.随机前3个月内出现过显著临床意义的出血症状或具有明确的出血倾向,如每日咳/咯血2.5ml及以上、消化道出血、有出血危险的食管胃底静脉曲张、出血性胃溃疡或患有脉管炎等。基线期,若大便潜血阳性,可复查。复查后若仍为阳性,需要进行胃镜检查,若胃镜提示重度食管胃底静脉曲张,则不能入组(入组前3个月及以内接受胃镜检查排除此类情况者除外);
15.具有明显遗传性疾病;
16.曾接受过干细胞移植或器官移植;
17.具有精神类药物滥用史且无法戒除者或有精神障碍史者;
18.研究者判断可能会增加参加研究相关的风险、或者可能干扰研究结果的解释的其它重度、急性或慢性医学疾病或实验室检查异常;
19.研究者判断依从性不佳,或有其他情况导致不适合参加本试验的患者。
vNKT细胞vNKT(Variant natural killer T)细胞,同时具有NK细胞和CD8T细胞的重要特征,属于NKT细胞中的一种亚群,详细关于NKT细胞的介绍见文章:
— END —

新干细胞者说
- 科普 情怀 责任 -