皮肤作为人体最大的器官,兼具屏障保护、体温调节等多重功能,其结构复杂且含毛囊、汗腺等附属器。传统二维培养模型难以还原皮肤立体结构,动物模型又存在种属差异,而皮肤类器官的出现打破了这一困境。
一. 类器官构建技术复刻皮肤的精工智造
皮肤类器官的构建是对胚胎发育过程的模拟,涉及细胞来源、生物支架、信号调控等关键要素,核心技术可分为三个层面:
1.细胞来源是构建的基础,主要分为两类:一是成体干细胞,如表皮干细胞、真皮成纤维细胞等,取自人体活检组织,这类细胞的分化方向明确但来源有限;二是多能干细胞,包括胚胎干细胞(ESC)和诱导多能干细胞(iPSC),可通过重编程体细胞获得,具备无限增殖能力,弊端是存在脱靶分化风险。
2.生物工程技术为类器官提供生长的“土壤”。气液界面法通过可渗透膜分隔培养环境,促使细胞分层分化,是表皮模型构建的经典方法;3D生物打印技术能以亚毫米级精度逐层打印含细胞的生物墨水,构建多细胞异质结构;微流控技术则通过微通道,实现生长因子的时空精准调控,增强营养灌注效率。
3.支架与信号调控决定类器官成熟度。天然胶原水凝胶弹性模量可调,支持血管自发形成;合成PEGDA凝胶通过光交联成型,稳定性更强,但生物相容性低于天然胶原水凝胶。同时需调控WNT等信号通路,通过加装Wnt/β-catenin通路荧光报告系统,可优化类器官功能并用于药物筛选。
二. 从基础结构类器官到功能特化类器官
依据结构复杂度和功能特性,皮肤类器官可分为基础层状、附属器特异性、功能定制型三大类,各自承担不同的研究使命。
基础层状类器官是最成熟的模型,核心为表皮-真皮双层结构。表皮由角质形成细胞分化形成复层屏障,真皮层含成纤维细胞及细胞外基质。传统膜片状类器官已用于化妆品检测,但存在检测效率低的缺陷;清华大学研发的微球状类器官由核-壳结构组成,模仿双层皮肤结构,壳由培养的人角质形成细胞组成,类似于表皮,而模仿真皮的核心由人皮肤成纤维细胞和胶原蛋白组成。

微球皮肤类器官的制备
附属器特异性类器官聚焦毛囊、汗腺等特殊结构再生。毛囊类器官通过共培养表皮干细胞与真皮乳头细胞,在WNT信号驱动下形成毛发结构;汗腺类器官可通过EDA基因重编程,将表皮细胞转化为功能性汗腺细胞,为烧伤患者汗腺再生提供可能。
功能定制型类器官针对特定研究需求设计。药物筛选专用类器官整合荧光素酶报告系统,能快速响应药物对关键通路的调控作用;血管化类器官通过掺入内皮细胞,可形成血管网络,解决移植后的营养供应难题;疾病模型类器官则从患者iPSC诱导而来,可模拟鱼鳞病等遗传性皮肤病的病理特征。
三. 多机制协同促进创面修复及转化应用
皮肤类器官通过促进上皮化、血管新生、炎症调控等多重机制,为急性创伤、慢性创面等多种伤口修复提供新策略,其应用已覆盖不同损伤类型。
在急性创伤修复中,类器官可加速创面闭合。2024年《Bioactive Materials》研究显示,3D生物打印皮肤类器官移植后,能显著加快免疫缺陷小鼠全层皮肤缺损愈合,优于现有的皮肤替代物。
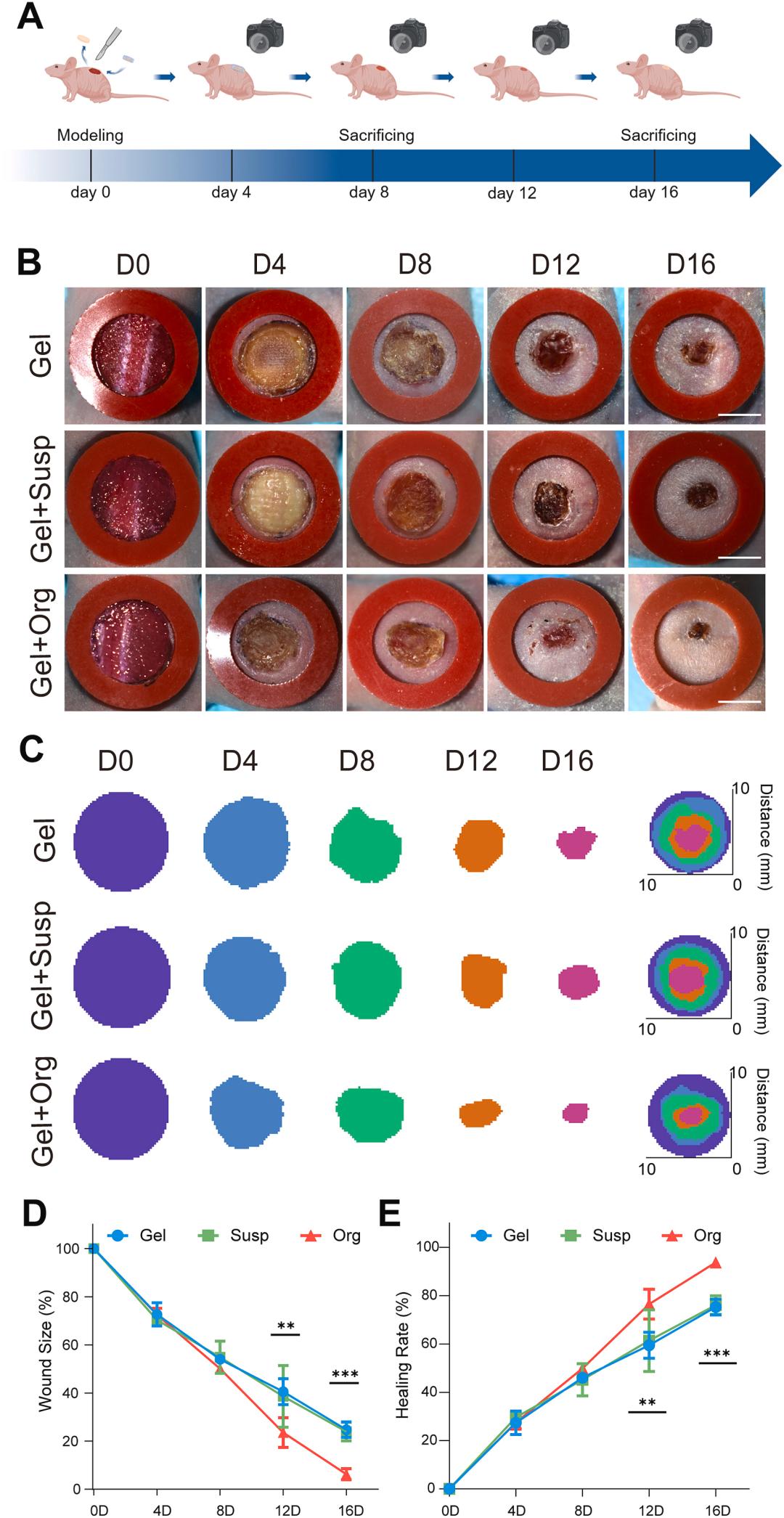
3D生物打印皮肤类器官促进免疫缺陷小鼠皮肤缺损闭合的疗效
2025年《Protein Cell》研究则证实,人诱导性多能干细胞(hiPSC)来源的皮肤类器官联合明胶水凝胶的治疗体系,可通过减轻冻伤后的早期炎症反应、提高表皮干细胞占比,显著加速创面愈合。
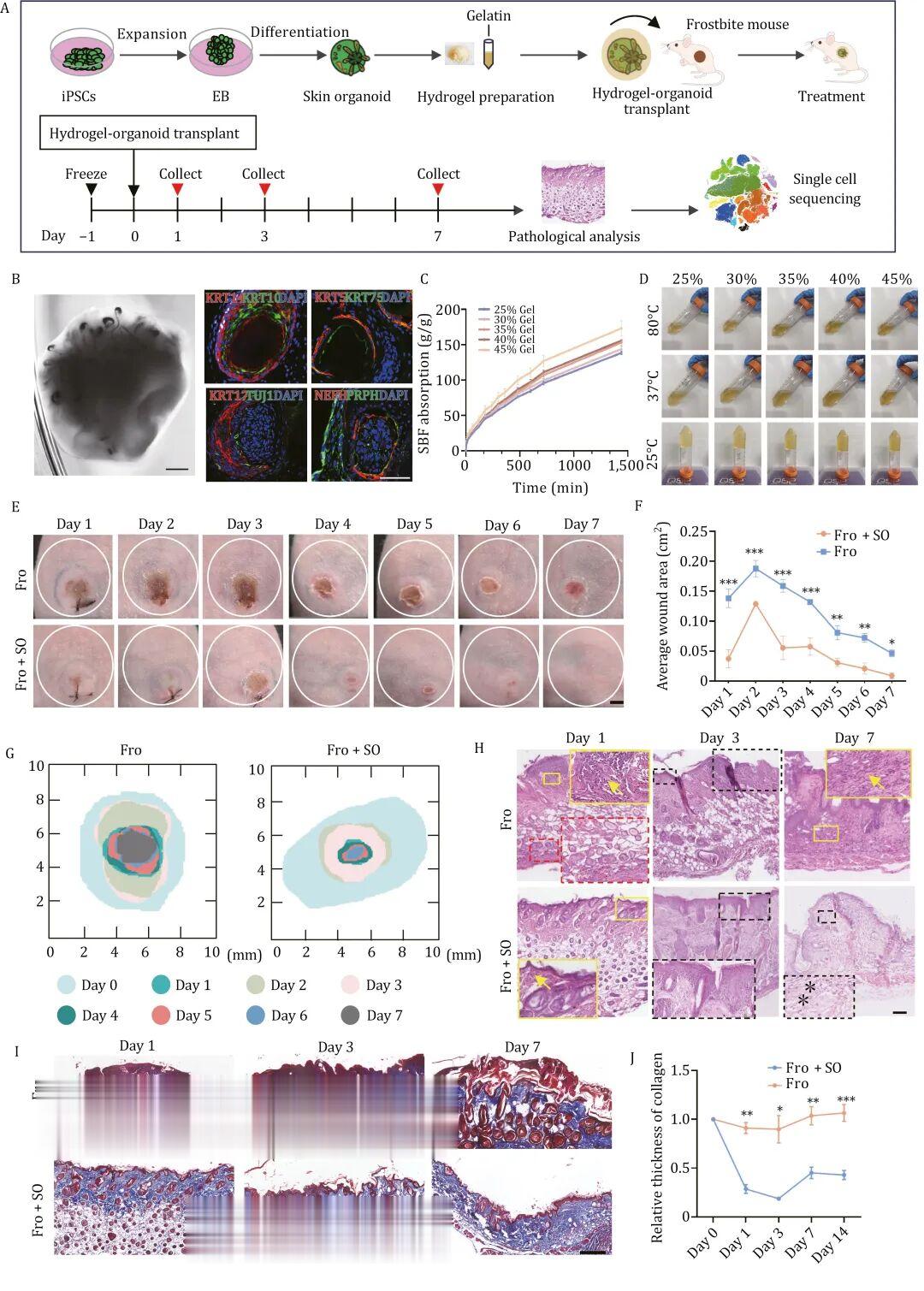
明胶水凝胶包裹的皮肤类器官可促进冻伤皮肤的伤口愈合
附属器再生是类器官的独特优势。带毛囊的皮肤类器官移植后可与宿主表皮整合,再生出可见毛发,这一过程依赖真皮细胞的机械力驱动;汗腺类器官则能保持干细胞特性,在创面分化为汗腺细胞,恢复皮肤的排汗功能,解决重建附属器的难题。
此外,类器官还可用于创伤机制研究与药物开发。通过模拟烧伤、冻伤等不同损伤的病理微环境,能揭示创面延迟愈合的分子机制;微球状类器官则凭借均一性高的优势,实现促愈合药物的高通量筛选,加速新药转化进程。
四. 临床试验:从实验室走向临床的探索之路
当皮肤类器官在实验室中完成基础效能验证后,其转化应用便迈入了临床试验的关键阶段。从重度烧伤修复到难愈性糖尿病足溃疡治疗,多款类器官相关产品已开启临床探索,既涌现出一些颇具潜力的疗法,也暴露出成本、安全性与监管层面的多重行业挑战。
由CUTISS公司申办的denovoSkin™治疗重度烧伤的3期患者内随机对照试验(NCT06745557),于2024年12月启动,该试验在荷兰展开,针对12岁及以上重度烧伤人群,旨在验证denovoSkin™的疗效与安全性。该疗法为含自体成纤维细胞和角质形成细胞的双层胶原工程化皮肤移植物,以断层皮片移植(STSG)为对照,核心研究目标是对比二者在深二度及三度烧伤患者创面闭合、瘢痕减少方面的效果及功能表现,为重度烧伤的修复治疗提供新的临床依据。
2025年11月底,denovoSkin™的2期临床试验结果正式发表于《eClinicalMedicine》,术后3个月时,试验组与对照组区域均实现完全上皮化。移植后长达12个月的疤痕评估显示,denovoSkin™未出现具有临床意义的疤痕,而断层皮片移植则多出现增生性疤痕。本研究所得证据进一步佐证生物工程皮肤可成熟为接近天然皮肤的组织,有望成为皮肤替代治疗领域新的金标准。从重度烧伤患者的初步治疗经验来看,denovoSkin™有助于提升患者生存率、改善皮肤长期修复效果,并最终提高烧伤幸存者的生活质量。
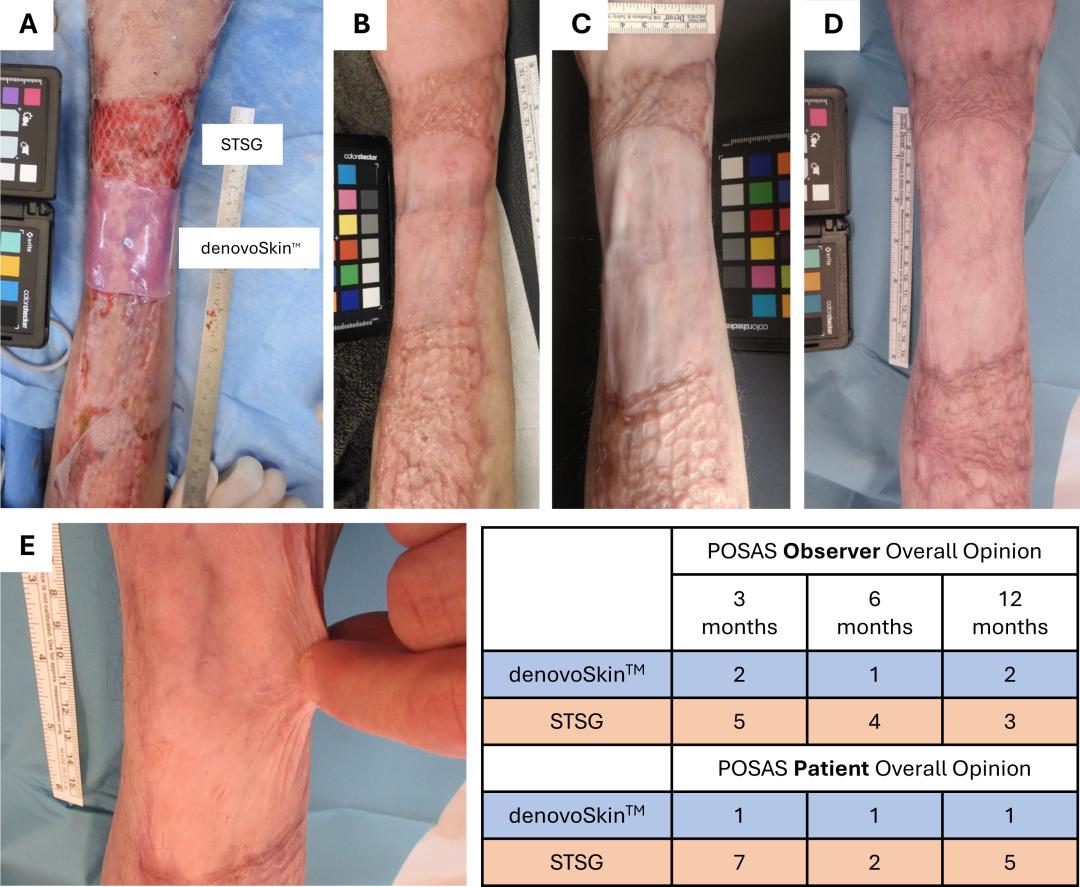
移植到右前臂的denovoSkin™显示出良好的疗效
由StimLabs申办的CAMPSTIM试验(NCT06449638)于2024年7月启动,在美国多地展开,该多中心随机对照研究对比四种人胎盘源皮肤替代物(Revita®、Relese®、Cogenex®、Enverse®四种细胞、无细胞、基质样产品)联合标准疗法(SOC)与SOC单用,旨在评估12周内难愈性糖尿病足溃疡的完全闭合疗效,为这类创面治疗提供新方案参考。
当前临床试验面临三大挑战:一是类器官规模化制备成本高,单例移植费用高昂;二是长期安全性数据缺乏,类器官的体内稳定性仍需长期追踪;三是监管标准缺失,各国尚未形成统一的类器官临床应用规范。
五. 未来展望
皮肤类器官的发展正朝着更精准、更高效、更贴近临床的方向迈进。微流控类器官芯片可模拟皮肤与其他器官的相互作用,为药物全身毒性评估提供平台。AI驱动的高通量培养系统则能实现类器官的标准化生产,降低制备成本。
随着技术的不断突破,未来我们有望实现“按需定制”的皮肤再生,让烧伤患者重获完整皮肤,让脱发者再生秀发,让慢性创面患者摆脱长期病痛困扰。这一融合了干细胞生物学与生物工程的前沿技术,正为皮肤医学打开前所未有的想象空间。
参考资料
1.Shi, Chenghai et al. Zhongguo xiu fu chong jian wai ke za zhi = Zhongguo xiufu chongjian waike zazhi = Chinese journal of reparative and reconstructive surgeryvol. 39,10 (2025): 1351-1355. doi:10.7507/1002-1892.202506040
2.Qin X, Liu H, Gan Z, Qin J. Application of hydrogel materials for organoids. Sci Sin Chim, 2024, 54: 182–195, doi: 10.1360/SSC-2023-0129
3.Xie, Jundong, et al. "The Bioengineering of Microspheric Skin Organoids and Their Application in Drug Screening." Advanced Science12.22 (2025): 2416863.
4.Zhang, Tao, et al. "3-D bioprinted human-derived skin organoids accelerate full-thickness skin defects repair." Bioactive materials42 (2024): 257-269.
5.Wang, Wenwen, et al. "Skin organoid transplantation promotes tissue repair with scarless in frostbite." Protein & Cell16.4 (2025): 240-259.
6.Meuli, Martin, et al. "Safety and efficacy of bio-engineered, autologous dermo-epidermal skin grafts in adolescent and adult burn patients: 1-year results of a prospective, randomized, controlled, multicenter phase IIB clinical trial." eClinicalMedicine90 (2025).
— END —

新干细胞者说
- 科普 情怀 责任 -