2025年11月25日,慢性自发性荨麻疹新药-瑞米布替尼片获中国国家药品监督管理局批准上市,该药是国内首个获批用于CSU的口服小分子布鲁顿酪氨酸激酶(BTK)抑制剂,由诺华公司研发,适用于H1抗组胺药控制不充分的成人慢性自发性荨麻疹(CSU)患者。
慢性自发性荨麻疹(CSU)是一种看似普通却极度困扰生活的疾病,患者的皮肤反复出现风团和难以忍受的瘙痒,且症状来去无常。在中国,有超过1000万人正承受着这种疾病的困扰,其中20至40岁的女性尤为多见。对于这些患者而言,抗组胺药长期以来是标准的一线治疗方案。然而,接近半数的患者对其反应不佳,即使增加剂量,症状依然无法有效控制。而另一类有效的注射生物制剂,则可能因治疗成本、可及性和用药便利性等问题,将部分患者拒之门外。
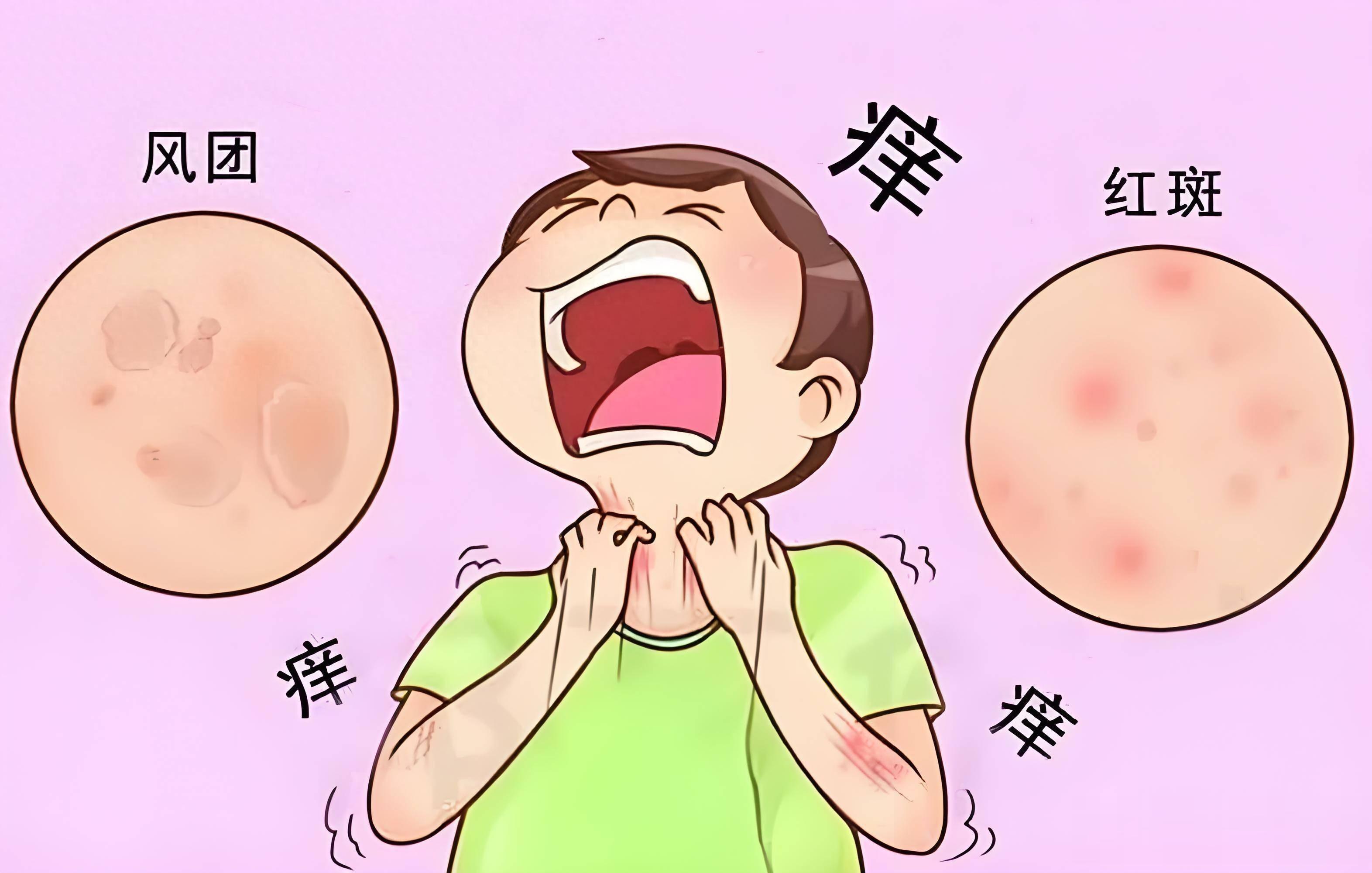
瑞米布替尼的上市,突破了这种治疗困境,同时也标志着我国CSU治疗进入了靶向治疗的新阶段,为大量传统治疗应答不佳的患者提供了的新选择。那么瑞米布替尼是什么类型的药物,疗效和安全性如何?我们一起来看看。
瑞米布替尼是什么药?瑞米布替尼是一款每日一次的口服片剂,它属于布鲁顿酪氨酸激酶(BTK)抑制剂,通过抑制BTK的活性,从源头上抑制肥大细胞和嗜碱性粒细胞这两种关键免疫细胞的异常活化,从而阻止组胺、白三烯等致炎介质的释放,从根源上缓解慢性自发性荨麻疹的核心症状,包括风团、瘙痒和血管性水肿。
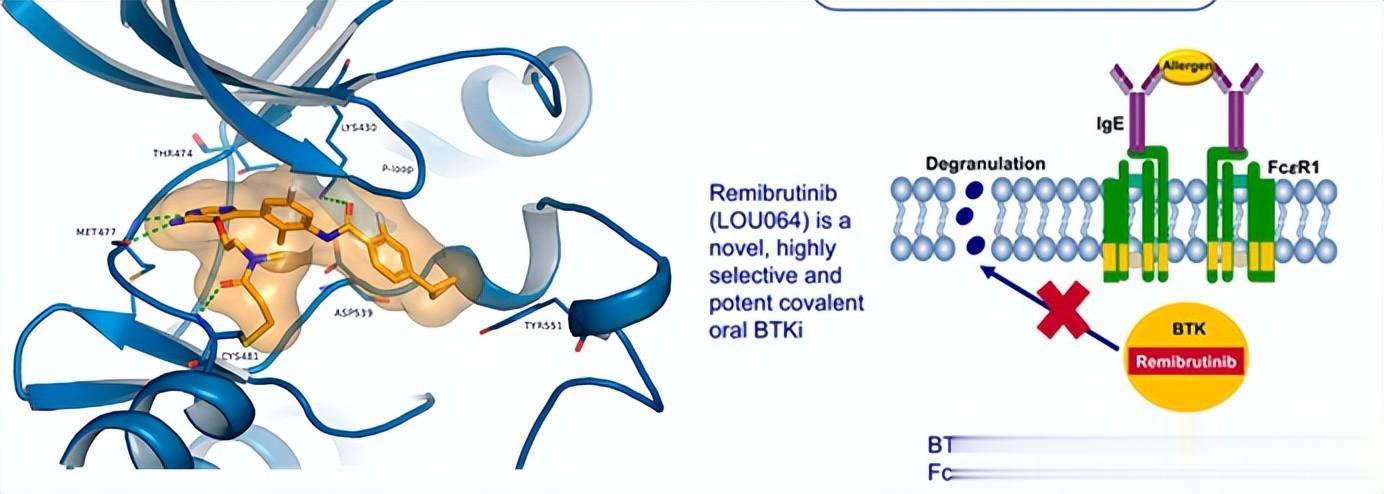
值得一提的是,该药不仅是美国FDA批准的首个用于CSU的BTK抑制剂,其在中国也通过“优先审评”通道,经历9个月就获批上市,这背后离不开其坚实的临床试验数据支持。
瑞米布替尼疗效和安全性?瑞米布替尼治疗慢性自发性荨麻疹的卓越疗效与可靠性,基于两项名为REMIX-1和REMIX-2的国际大型III期临床试验。这两项随机双盲、安慰剂对照的严谨研究,针对超过900名例入组前6个月或更久确诊为CSU,且二代H1抗组胺药治疗后症状仍持续的患者,具有广泛代表性。
试验数据显示,该药起效迅速,治疗第一周即可显著改善患者的瘙痒和风团症状;至第12周时,其核心疗效指标——荨麻疹活动度评分(UAS7)的改善幅度显著优于安慰剂组,在两项研究中分别较安慰剂多降低6.2分和7.7分,统计学差异极显著(P<0.001)。更值得关注的是,该药的疗效随着治疗时间延长而愈发凸显,展现出出色的持久性。研究设计中的一个关键环节是,在第24周时将安慰剂组患者转换至瑞米布替尼治疗,结果发现这些患者也能在换药第一周就迅速产生疗效响应,且疗效一直持续到研究结束,这有力地证明了无论患者处于何种病程阶段,该药都能为其带来及时且可靠的症状控制。
在提供卓越疗效的同时,瑞米布替尼也展现出可靠的安全性,在整个52周的研究期内,其总体不良事件发生率与安慰剂组相当,且绝大多数为鼻咽炎、头痛等轻中度反应,研究中未发生与药物相关的严重不良事件。这一“高效且安全”的特性,使其有潜力重塑临床实践。
对于超过半数对抗组胺药应答不佳的患者而言,瑞米布替尼作为一个便捷的口服靶向药,提供了突破性的解决方案,未来极有可能被正式纳入治疗指南,推动CSU治疗进入精准管理的新阶段。