转自:生物谷
有人顿顿大鱼大肉却血脂正常,有人清淡饮食仍代谢紊乱——这种“不公平”的背后,藏着基因对新陈代谢的隐秘调控。如今,伦敦玛丽女王大学团队发表在《NatureGenetics》的研究,用50万人的基因数据绘制出全球最大规模“人类代谢遗传图谱”,不仅找到249种血液代谢物的基因“操控者”,更发现心血管病、糖尿病等代谢性疾病的全新防治靶点,为精准医疗按下“加速键”。
全球每年约1790万人死于心血管疾病,血脂异常、代谢紊乱是核心诱因。过去,科学家对基因与代谢的关联研究多局限于小样本或单一族群,难以揭示普适规律。
这次研究团队整合英国生物银行45万人(涵盖欧洲、非洲、南亚三大族群)的基因数据,用核磁共振技术精准测量249种代谢物,包括14种脂蛋白亚型(如超大极低密度脂蛋白、小高密度脂蛋白)、氨基酸、酮体等关键指标,最终识别出29824个“基因-代谢物”关联,定位到753个基因组区域,相当于为代谢调控找到了数百个“基因开关”。
更令人意外的是,这些基因调控模式在不同族群和性别中高度一致。比如非洲族群中常见的CD36基因变异(欧洲族群中罕见),会降低欧米伽3脂肪酸浓度,与该基因在脂肪酸转运中的功能完全匹配;男女之间代谢相关基因的效应相关性高达0.98,仅360个位点存在轻微性别差异,且方向一致,说明人类代谢的遗传基础具有跨族群、跨性别的普适性。这种一致性为开发通用型代谢疾病药物提供了重要依据。
研究不仅验证了已知代谢基因的作用,更挖出一批“新角色”。比如过去较少被关注的SIDT2基因,其罕见变异会影响高密度脂蛋白(HDL,“好胆固醇”)的分泌,携带该变异的人,HDL相关代谢指标异常的概率显著升高;JAK2基因的罕见突变不仅与血液疾病相关,还会通过影响胆固醇转运蛋白ABCA1,降低HDL清除胆固醇的能力,间接增加心血管病风险。这些发现将原本分散的研究线索串联,为代谢调控机制补上关键拼图。
团队还首次分析了“从罕见到常见”全频谱基因变异的代谢效应。比如SLC13A5基因,无论是罕见的功能缺失变异(每拷贝使柠檬酸浓度升高1.4个标准差),还是常见的多态性位点,都指向柠檬酸代谢异常,形成清晰的“等位基因系列”;ANKH基因的4个常见变异和1个罕见变异,则共同调控血清柠檬酸水平,这种“罕见-常见”变异的协同效应,为理解代谢疾病的遗传多样性提供了全新视角。
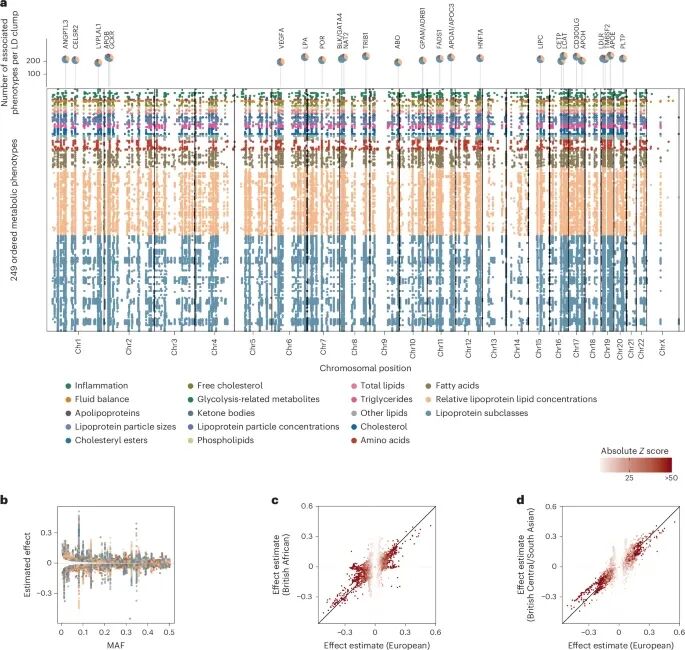
循环代谢产物的共同遗传调控
更关键的是,研究找到代谢与疾病的“基因桥梁”。比如血管内皮生长因子基因(VEGFA),过去因调控血管生成被用于癌症治疗,此次发现其变异会影响HDL颗粒大小——携带特定变异的人,HDL颗粒更大,冠心病风险降低35%(OR=0.65,95%CI0.50-0.83)。这意味着,未来或可通过调控VEGFA改善HDL功能,为无法通过他汀类药物降低心血管风险的患者,提供全新治疗路径。类似地,PNPLA3基因变异虽不直接影响低密度脂蛋白(LDL,“坏胆固醇”),却会改变LDL颗粒大小和极低密度脂蛋白(VLDL)特性,解释了为何部分人LDL正常仍有心血管风险。
值得注意的是,研究还揭示了基因“多效性”的复杂模式:约一半代谢相关基因会通过“垂直多效性”调控上下游代谢通路(如ANGPTL3基因同时影响甘油三酯、HDL和磷脂),另一半则通过“水平多效性”影响互不相关的代谢过程(如APOB基因同时调控脂蛋白和肌酐)。这种分类为区分“因果代谢物”和“伴随代谢物”提供了依据,避免后续药物研发走弯路。
尽管基因对代谢影响显著,但研究人员强调,代谢是基因与环境共同作用的结果。比如携带相同代谢风险基因的人,规律运动和健康饮食仍能显著降低疾病风险。未来,通过解读个人“代谢基因图谱”,医生可精准预测代谢疾病风险,甚至定制饮食和用药方案,比如对VEGFA变异携带者,优先推荐能改善HDL功能的干预措施,让“精准防治”从概念走向现实。
这项研究不仅填补了代谢遗传领域的空白,更让我们看清:基因不是代谢的“宿命”,而是健康管理的“导航图”。当我们终于读懂这些藏在基因里的“代谢密码”,或许就能真正掌握健康主动权,让“喝凉水都长肉”的无奈,成为过去式。
参考文献:
Zoodsma,M.,Beuchel,C.,Yasmeen,S.etal.Ageneticmapofhumanmetabolismacrosstheallelefrequencyspectrum.NatGenet(2025).doi:10.1038/s41588-025-02355-3