百年来,胰岛素制剂不断发展迭代,其中基础胰岛素研发一直追求更长效的平稳降糖,但始终囿于每日注射的困境之中,直至全球首个基础胰岛素周制剂——依柯胰岛素成功问世。那么,依柯胰岛素是如何通过精巧的药物分子设计,来实现从日到周的百年突破呢?
本刊特邀中国医学科学院北京协和药物研究所吕晓希教授,从药学视角为您解锁胰岛素周制剂的研发秘密,系统阐述依柯胰岛素分子结构的创新设计、药代动力学(PK)/药效动力学(PD)特征,并对与临床应用密切相关的多项Ⅰ期临床研究进行全面解读。

一、揭秘药物设计的精妙玄机:基于脂肪酸酰化技术,对人胰岛素分子进行创新改造
为进一步延长作用时间,在胰岛素周制剂研发过程中,多种创新技术各展所长,其中脂肪酸酰化技术尤为突出。这一成熟技术已被用于多种长效药物的研发创新,其应用于基础胰岛素的基本原理是人为通过化学方法将脂肪酸侧链连接在人胰岛素分子上,进而改变其生物特性,延长半衰期。依柯胰岛素基于脂肪酸酰化技术,通过精妙的药物设计来实现“周注射”(图1)[1,2]。
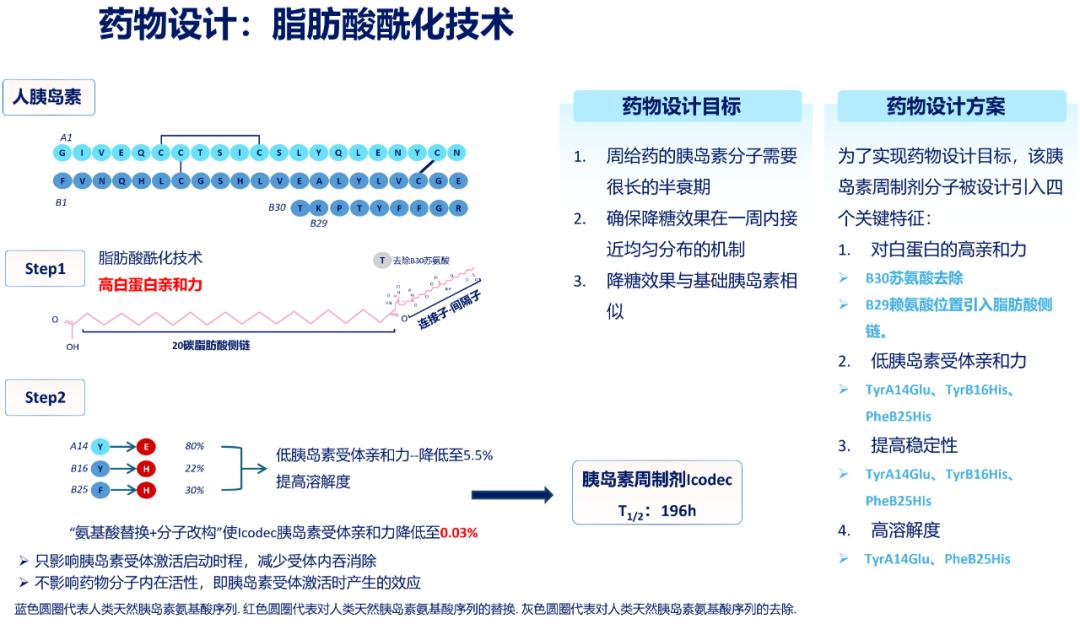
图1. 依柯胰岛素药物设计概览
依柯胰岛素长效秘诀:
详解脂肪酸酰化技术四大要素
脂肪酸酰化技术的四大结构要素包括脂肪酸侧链、连接子、间隔子、肽链骨架(图2)[3]。依柯胰岛素延续脂肪酸酰化技术,对人胰岛素分子进行结构改造,去掉B30位苏氨酸,在B29位上通过“连接子-间隔子”连接20碳脂肪二酸侧链,从而实现与白蛋白强效且可逆的结合,并降低依柯胰岛素与受体的亲和力。下面来看看四个结构要素分别发挥怎样的作用。
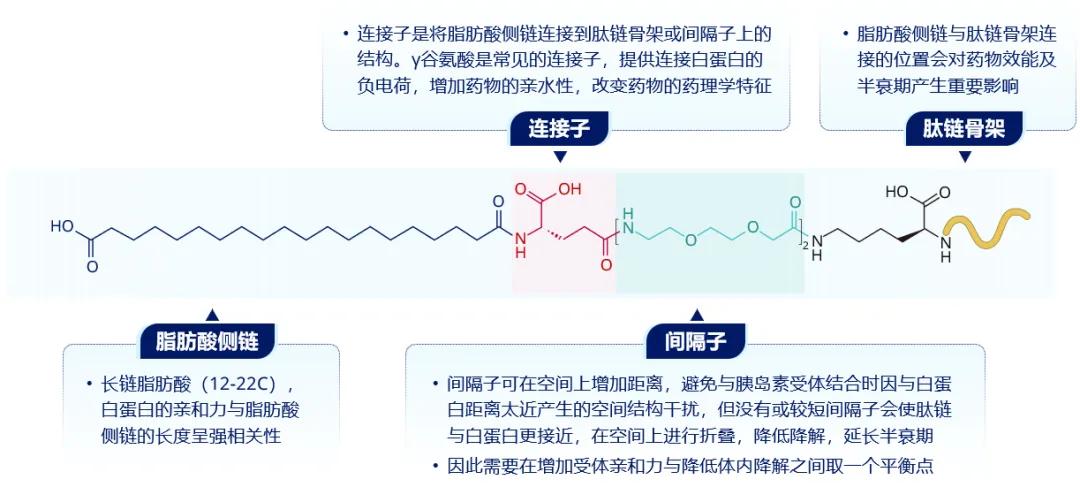
图2. 脂肪酸酰化技术四大结构要素(以依柯胰岛素为例)
脂肪酸侧链:这是脂肪酸酰化技术的核心结构要素,脂肪酸侧链越长,与白蛋白的结合力就越强。20碳脂肪酸侧链是目前与白蛋白亲和力极强的一种脂肪酸,使得依柯胰岛素与白蛋白形成可逆性结合,避免药物通过肾脏排泄以及避免蛋白酶对药物的攻击,从而显著延长半衰期。而且,这种结合为可逆性,当药物从白蛋白上解离下来,即可恢复活性,发挥降糖作用。但需注意,延长脂肪酸侧链会增加药物的脂溶性,降低其水溶性。
连接子:这是将脂肪酸侧链连接到肽链骨架或间隔子上的结构,可提供与白蛋白结合的负电荷,增加药物亲水性。依柯胰岛素的连接子为γGlu(γ谷氨酸),是一个高水溶性的功能团,其通过增加药物的亲水性,平衡因延长脂肪酸侧链而增加的药物脂溶性,进而改善药物的溶解度和稳定性,避免制剂中产生药物沉淀,减少注射疼痛感。
间隔子:位于肽链骨架与连接子之间,主要作用为调节药物与胰岛素受体的亲和力,并减少体内降解。依柯胰岛素的间隔子为2×OEG(两个二氧-氨基辛酸),可发挥类似人体“关节效应”,赋予脂肪酸侧链柔韧性,使侧链能够如“鞭子”般摆动,让依柯胰岛素从胰岛素受体上解离下来,既减少了受体介导的胰岛素清除,又可实现脉冲式激活,增加药物敏感性。
肽链骨架:氨基酸序列改变也会影响药物特性。依柯胰岛素肽链骨架进行了3处氨基酸替换:将A14位的酪氨酸替换为谷氨酸(A14E),B16位的酪氨酸替换为组氨酸(B16H),B25位的苯丙氨酸替换为组氨酸(B25H),进一步降低胰岛素与受体亲和力,减少受体介导的清除,同时增加分子稳定性。
依柯胰岛素延长作用机制
正是基于以上脂肪酸酰化技术,依柯胰岛素在基础胰岛素发展史上率先实现长达196小时的半衰期[4],成为全球首个基础胰岛素周制剂。其半衰期延长机制如图3所示:
依柯胰岛素皮下注射后吸收入血液循环,因其引入20碳脂肪酸侧链,在血液循环中与白蛋白强效可逆性结合,形成无活性的白蛋白结合储库,并从储库中缓慢、持续地释放出活性胰岛素,如“涓涓细流”般作用于靶器官和组织,这种白蛋白结合储库是其主要的延长作用机制。
在进入靶组织后,依柯胰岛素与胰岛素受体结合,由于间隔子作用以及肽链骨架的氨基酸替换,使其与胰岛素受体亲和力降低,减少受体介导的胰岛素清除,半衰期进一步延长。

图3. 依柯胰岛素延长作用机制示意图
二、PK/PD研究验证长效机制:依柯胰岛素体内代谢过程及药理学特征
PK/PD研究验证了基础胰岛素周制剂的长效作用机制。正葡萄糖钳夹试验是描述基础胰岛素PK/PK特征的“金标准”,其结果分别以浓度-时间曲线和时间-作用曲线来描绘[5]。依柯胰岛素的正葡萄糖钳夹研究系统展现了其在2型糖尿病(T2DM)患者中的PK/PD特征[6]。
PK结果显示,依柯胰岛素半衰期长达196小时,达到最大浓度的中位时间为16小时(图4),可满足每周一次注射需求;3~4次注射后即可达到临床稳态[6]。依柯胰岛素的PK参数血药浓度为白蛋白结合药物与游离药物的总和,只有游离药物具有降糖作用;依柯胰岛素的PD参数(如葡萄糖输注率)更能反映游离药物的水平,具有临床意义[7]。PD结果显示,稳态下,葡萄糖输注率曲线下面积(AUCGIR)在一周7天内的分布比例为12.0%~16.3%,提示依柯胰岛素稳态下一周内降糖疗效的日间分布接近平均;每周一次给药,达到稳态后持续降糖作用可覆盖一周(图5),有效满足患者一周的基础胰岛素治疗需求[6]。因此,PK和PD研究结果均支持依柯胰岛素每周一次注射。
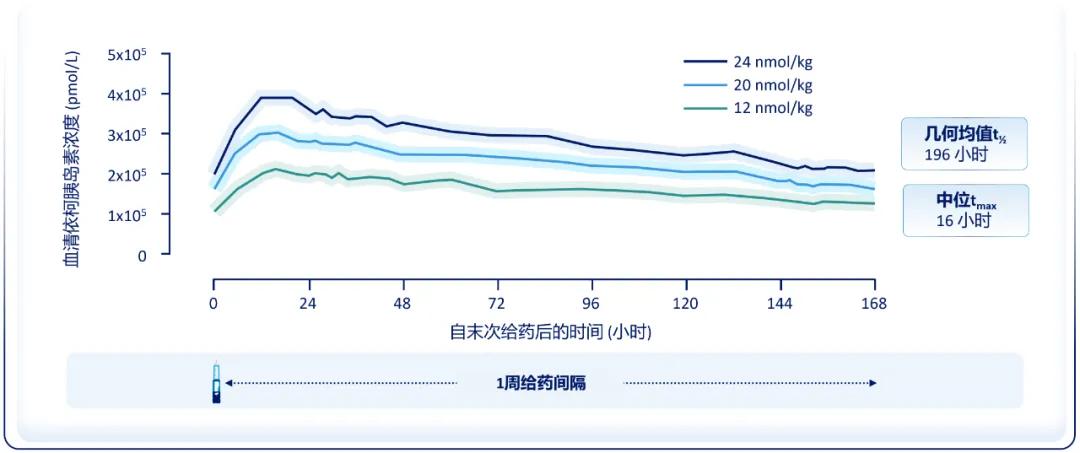
图4. 依柯胰岛素的浓度-时间曲线
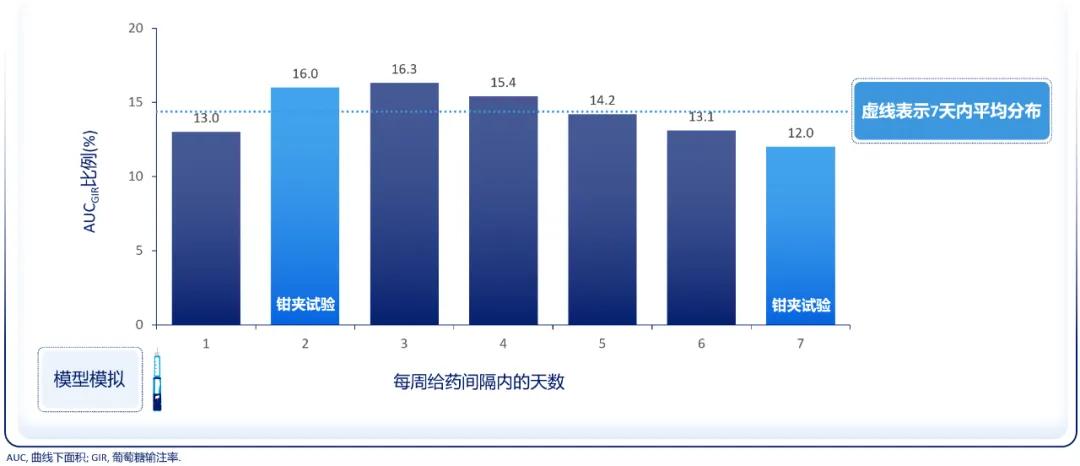
图5. 依柯胰岛素稳态下一周内的降糖效果分布
三、全面解析Ⅰ期临床研究:为依柯胰岛素临床应用提供更多参考
多项Ⅰ期临床研究从不同角度,全面评估了依柯胰岛素在不同使用情况下的药理学特征,为临床实践应用提供重要参考。
与基础胰岛素间的衔接:既往使用基础胰岛素的T2DM患者,首次转换为依柯胰岛素治疗时,相较于正常剂量给药(达稳态时间为3~4周),使用150%剂量给药,可更快达到稳态(2~3周)[8]。不同注射部位的影响:一项研究比较T2DM患者在不同部位(大腿、腹部或上臂)皮下注射依柯胰岛素的药理学特性。结果显示,PK方面,不同部位注射后依柯胰岛素总暴露量(AUC0~∞,单次注射)相似;PD方面,不同部位注射后依柯胰岛素36~60小时降糖效果(AUCGIR,36~60h,单次注射)相当。因此,依柯胰岛素可在大腿、腹部或上臂进行皮下注射,其暴露量和降糖效果相似[9]。
肝肾功能损害人群:PK研究结果显示,健康受试者与肝、肾功能损害受试者之间依柯胰岛素暴露量未见有临床意义的差异。在肝、肾功能损害受试者中进行的PK研究显示,不同程度肝、肾功能损害受试者的血清白蛋白浓度对依柯胰岛素总暴露量无影响[10]。这提示,肝、肾功能损害者均无需特别调整依柯胰岛素剂量。
血清白蛋白水平的影响:稳态时依柯胰岛素最大血清浓度(<500 nmol/L)远低于血清白蛋白浓度(600 000 nmol/L),每个白蛋白分子至少有4个高亲和力结合位点。因此,循环中的白蛋白结合位点超出所需2000倍以上,血清白蛋白浓度不影响依柯胰岛素的临床疗效[4]。
四、结语
依柯胰岛素是药学技术发展史上的一个里程碑,其基于脂肪酸酰化技术,通过精巧的分子设计,使胰岛素能够如“涓涓细流”般持续释放,超长效平稳控糖,百年来首次突破日注射限制,实现了基础胰岛素每周一次注射,引领胰岛素治疗新方式。依柯胰岛素具有优秀的药理学特征,且降糖效果不受注射部位影响,可用于肝、肾功能不全及白蛋白水平降低的患者,助力广泛T2DM患者实现高效且便捷的血糖管理。
参考文献
1. Kjeldsen TB, et al. J Med Chem. 2021; 64(13): 8942-8950.
2. Hubálek F, et al. Nat Commun. 2024; 15(1): 6124.
3. Kurtzhals P, et al. Nat Rev Drug Discov. 2023; 22(1): 59-80.
4. Nishimura E, et al. BMJ Open Diabetes Res Care. 2021; 9(1): e002301.
5. Liu S, et al. Acta Pharmaceutica Sinica B. 2012; 2(4): 403-410.
6. Nishimura E, et al. BMJ Open Diabetes Res Care. 2021; 9(1): e002301.
7.《基础胰岛素周制剂依柯胰岛素治疗2型糖尿病临床应用专家指导建议》专家组. 中华糖尿病杂志. 2025; 17(9): 1110-1116.
8. Pieber TR, et al. Diabetes Obes Metab. 2023; 25(12): 3716-3723.
9. Plum-Moerschel L, et al. Clin Drug Investig. 2023; 43(2): 119-127.
10. Haahr H, et al. Clin Pharmacokinet. 2024, 63(6): 819‑830.