欧洲动脉粥样硬化学会(EAS)2021年共识声明强调,TG是ASCVD的独立危险因素,富含甘油三酯的脂蛋白(TRL)及其残粒与ASCVD存在因果关联,高甘油三酯血症已成为国际公认的血脂相关心血管剩余风险的重要组成部分。为解决这一剩余风险,学术界针对贝特类、烟酸类和鱼油类等降TG药物展开大量研究。多项研究显示出降低TG的效果,但并未能降低患者心血管复合风险。
在众多相关研究中,REDUCE-IT研究脱颖而出,其针对特定高甘油三酯人群,以二十碳五烯酸乙酯(IPE,EPA的乙酯化形式,含EPA纯度≥96%)为干预药物,实现心血管获益达25%以上,研究证实的这一获益并非单纯源于TG水平降低,基于此,本刊邀请中国医学科学院阜外医院郭远林教授围绕REDUCE-IT研究展开IPE心血管获益机制探究,同时特别邀请复旦大学附属中山医院钱菊英教授、广东省人民医院荆志成教授进行点评。
REDUCE-IT研究回顾
REDUCE-IT研究[1]是一项双盲、随机、安慰剂对照试验,纳入全球11个国家 473家医学中心的8179例患者。所有患者年龄≥45岁且患有心血管疾病,或年龄≥50岁且患有糖尿病合并至少有1项心血管风险因素,同时需接受他汀类药物治疗至少4周,基线甘油三酯水平在1.52~5.63 mmol/L、LDL-C在1.06~2.59 mmol/L。研究主要结局为主要复合心血管事件发生率,包括心血管死亡、非致死性心梗、非致死性卒中、冠状动脉血运重建或因不稳定型心绞痛住院。
研究结果令人瞩目,无论是整体人群还是不同脂蛋白水平分层的人群,IPE治疗组主要复合心血管事件发生率均显著低于安慰剂组。整体人群中,IPE治疗组风险降低25%;在由心血管死亡、非致死性心梗或非致死性卒中组成的关键次要硬终点方面,IPE治疗组表现更优,获益高达26%。这一结果表明,IPE对心血管疾病具有明显的保护作用,为后续探究其获益机制奠定了坚实基础。
获益机制探讨1:TG降低方式?
1.减少VLDL-TG合成与分泌
在降脂方面,IPE通过多重机制降低TG水平。研究表明[2],EPA可降低肝脏极低密度脂蛋白甘油三酯(VLDL-TG)的合成和/或分泌。它能在肝内增加β-脂肪酸氧化,减少TG生成,同时抑制二酰甘油酰基转移酶(DGAT),进而减少TG分泌,从源头减少VLDL颗粒的合成与分泌,最终降低血浆TG水平。与其他单纯分解循环中VLDL颗粒内TG的药物机制不同,IPE从根本上减少了致动脉粥样硬化脂蛋白的产生,有助于降低心血管疾病风险。
2.提升VLDL颗粒中TG清除
IPE不仅减少VLDL-TG的合成与分泌,还能提高循环VLDL颗粒中TG的清除效率。通过增强血浆脂蛋白酶活性,使TG被酯解,VLDL颗粒得以清除,进一步降低血浆TG水平,减少血液中脂质的积累,改善血脂异常状况,这对于预防和减轻动脉粥样硬化进程具有重要意义。
获益机制探讨2——降脂外效应:治疗后EPA水平?
1.高水平EPA的关键作用
亚组分析显示的显著获益:在降脂外效应方面,高水平的EPA发挥了关键作用。REDUCE-IT研究预设亚组分析显示,治疗后EPA水平高的亚组获益最大。最高 EPA三分位组风险降低37%,是最低三分位组的2.5倍。从基线到第一年,IPE可使EPA水平增加386%[3],且研究中IPE组EPA的三分位数与心血管事件发生率的降低具有强烈的负相关关系。这表明治疗后维持高EPA水平是心血管获益的重要因素。与基线EPA水平的关联:一项前瞻性纳入944例接受直接经皮冠状动脉介入治疗的ST段抬高型心肌梗死(STEMI)患者的研究也表明,基线EPA水平高与3年主要心血管不良事件(MACE)风险低相关(图1)[4]。这进一步佐证了EPA在心血管保护中的重要作用,无论是治疗后提升的EPA水平,还是基线时较高的EPA水平,都与心血管风险的降低密切相关。

图1. EPA水平升高与心血管不良事件风险降低相关
2.与AA竞争代谢的抗炎与抗栓效应
抗炎效应:内皮功能障碍和炎症会推动动脉粥样硬化的形成,若未得到控制,最终可能导致斑块破裂和血栓形成。炎症在斑块破裂和缺血事件的发生中起着核心作用。EPA和花生四烯酸(AA)结构相似,均需通过环氧合酶和脂氧合酶代谢,但代谢产物性质迥异。EPA代谢产生抗炎和抗血小板聚集代谢物,综合效应倾向于抗炎(图2);而AA代谢产生促炎、促血小板聚集代谢物。改变EPA/AA比值可使代谢状态从促炎/促凝集转变为抗炎/抗凝集[5,6]。在REDUCE-IT研究中,超敏C反应蛋白(hs-CRP)显示出明显下降,这正是IPE通过与AA竞争代谢发挥抗炎效应的体现,有助于减轻血管炎症,稳定斑块,降低心血管事件风险。
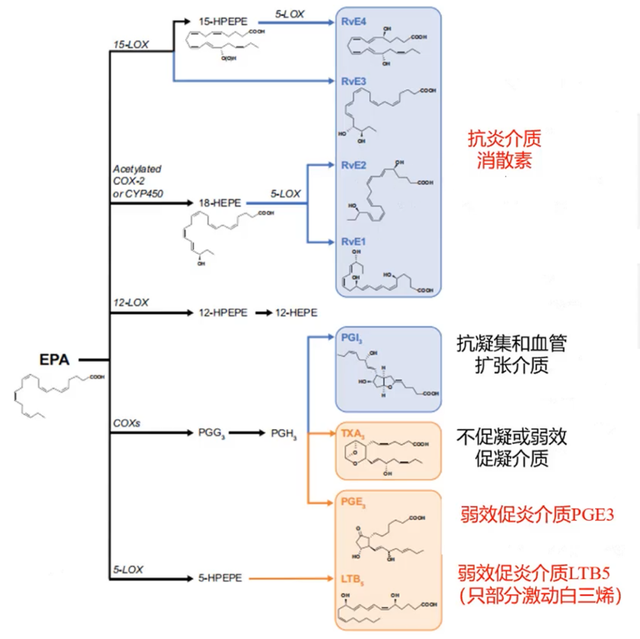
图2. EPA抗炎效应示意图
抗栓效应:在抗栓方面,花生四烯酸代谢产物血栓素A2(TXA2)具有缩血管和促血栓形成作用,而EPA的代谢产物血栓素A3(TXA3)无促血栓作用,前列环素 I3(PGI3)具有舒血管、抗聚集作用(图3)[5,6]。REDUCE-IT研究中,缺血事件大幅降低,同时出血事件有轻微增加趋势,这正是其抗栓效应的体现。REDUCE-IT研究的ACS亚组对出血事件风险做了再确认,在抗板、抗凝药物充分应用甚至双抗的治疗背景下,IPE组的出血事件在数值上甚至更低,IPE整体安全性可控,其抗栓效应在预防心血管事件方面发挥了重要作用。

图3. EPA与AA的抗炎与抗栓效应
最新研究指出:EPA对免疫细胞及相关基因的调节作用
近日,Bhatt等人发表在JACC的一项研究显示[7],EPA在免疫调节方面发挥着重要作用,为其心血管获益的降脂外效应提供了有力支持。在对非激活CD4⁺ T细胞的研究中,EPA能够降低免疫反应相关基因的表达,同时增强对抗氧化应激基因的表达。通过转录组分析可知,EPA可能阻止CD4⁺ T细胞激活和后续分化,调节与T细胞分化相关的转录因子。不仅如此,EPA治疗可诱导T细胞转录组发生抗炎性改变,这些改变与血管内皮细胞的蛋白质组学研究结果相辅相成。在T细胞和内皮细胞中,EPA水平可特异性增加HMOX1和NQO1基因的转录,其编码的蛋白质参与抗氧化反应[7,8],有助于减轻细胞氧化应激损伤,维护血管内皮功能,进而降低心血管疾病风险。除了REDUCE-IT研究先前报告的基于固有免疫生物标志物所评估的抗炎效果外,这种通过适应性免疫调节介导的抗炎作用(如Reilly等人[7]报告的对T细胞的影响),也进一步促进了心血管疾病风险的降低。EPA通过定向改变基因和蛋白质表达,在T细胞和内皮细胞中促进广泛的抗炎作用,这种作用除了降低甘油三酯外,还可能抑制动脉粥样硬化的疾病进展。除了减轻炎症和抑制T细胞活化外,与其他长链脂肪酸相比,EPA还能改善内皮血管舒张功能,提高一氧化氮的生物利用度,同时EPA通过阻碍自由基穿过脂质双层,抑制胆固醇结晶区域生成和脂质氧化(图4)[5,9]。这些作用进一步维护了血管的健康状态,降低了心血管疾病发生的风险。
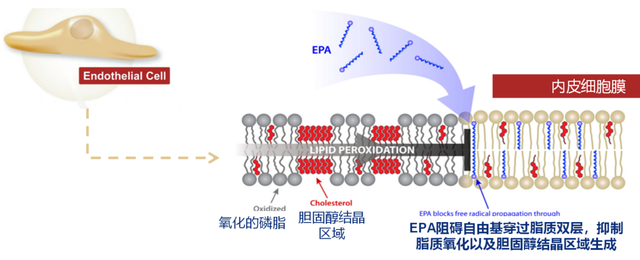
图4. EPA改善内皮功能:通过抑制内皮细胞膜胆固醇结晶区域生成
专家点评

钱菊英教授点评
在ASCVD的管理中,对于已接受最大耐受程度他汀治疗的人群,继续强化降低LDL-C不是最优的剩余风险管理策略。多不饱和脂肪酸的代谢衍生物参与细胞代谢调控过程,和炎症过程密不可分,炎症是与血脂异常相关心血管(CV)风险的关键[10]。
最广为人知的衡量炎症程度的脂质比例就是Omega-3和Omega-6脂肪酸的比值,即EPA:AA[10]。EPA和花生四烯酸(AA)结构相似,都需通过环氧合酶(COX)和脂氧合酶(LOX)代谢,但代谢产物性质截然相反。EPA代谢产生抗炎和抗血小板聚集代谢物,综合效应倾向于抗炎;而AA代谢产生促炎、促血小板聚集代谢物[11]。因此,EPA:AA比值是明确的ASCVD指标。
REDUCE-IT研究结果表明,采用EPA的乙酯化形式IPE(4g/天)进行治疗,可使主要不良心血管事件(MACE)风险降低25%,心血管死亡降低20%[1]。这种获益主要归因于IPE的抗炎和抗栓作用,且该作用独立于其降脂效果。研究进一步显示了血清EPA水平与心血管风险呈负相关,且存在剂量反应关系。研究人员还考察了治疗中EPA水平与其他心血管结局之间的关系。与安慰剂相比,治疗中EPA水平最高的患者因新发心力衰竭住院的情况显著减少[3]。此外,治疗中EPA水平与较低的心源性猝死和心脏骤停风险之间存在显著关联。
近期European Heart Journal发表的一项纳入15 000余例PCI患者的研究表明[12],在接受PCI的患者中,炎症而非单纯的LDL-C水平,可能是剩余心血管风险的主要驱动因素。研究发现,hs-CRP与不良心血管结局的关系比LDL-C水平更强,尤其在已接受降脂治疗的患者中。该研究的发现对临床治疗策略具有重要指导意义。除了传统的降脂治疗外,抗炎治疗应成为PCI患者管理的重要组成部分。IPE直击ASCVD剩余风险管理四大策略,具有抗炎、抗栓、降TG、抑制Lp(a)氧化多重心血管获益机制,在ASCVD患者的管理中具有着广泛的临床应用前景。

荆志成教授点评
问题1:IPE凭什么能降低心血管事件?——REDUCE-IT研究的突破
传统降脂药虽能降低胆固醇,但对高甘油三酯(HTG)人群的“剩余风险”束手无策。REDUCE-IT研究给出答案:在他汀治疗基础上,IPE让这类患者的心梗、卒中等风险直降25%[1]!更惊人的是,对于LDL-C已达标(<1.4 mmol/L)的患者,风险降幅达34%[13]。这说明IPE的益处远超单纯降脂,是“多管齐下”的结果。
问题2:IPE如何实现“多管齐下”?——三大核心机制
1.治本降脂
源头堵截:减少肝脏生产“坏脂肪”(VLDL-TG),相当于掐断动脉粥样硬化的“原料供应”[14]。加速清理:提升血液中“清洁工”(脂蛋白脂肪酶)的效率,快速清除多余TG。2.稳定斑块
逆转高危斑块:影像学(EVAPORATE研究)证实[15],IPE治疗18个月,让易破裂的“软斑块”(低衰减斑块)体积减少17%,而同期对照组的患者斑块反而增长109%!这类斑块正是心梗的“定时炸弹”。改善血流:最新EVAPORATE-FFRct研究(评估了IPE对冠状动脉生理学的影响)发现[16],IPE在9个月和18个月的随访中都能显著改善了冠状动脉平均远端节段血液储备分数(FFRct),改善了冠状动脉的血流动力学情况,相当于给心脏供血的“高速公路”拓宽车道,减少堵车风险。3.抗炎护血管
“灭火队长”:EPA能压制血管炎症(如降低hs-CRP),抑制“炎症风暴”对血管的破坏。修复内皮:增强血管舒张功能,相当于给血管“松绑”,改善血液流通。问题3:哪些患者最该用IPE?——精准锁定获益人群
他汀治疗后,TG仍高(≥1.5 mmol/L)的心血管病患者或糖尿病高危人群[1];检查发现冠状动脉有“软斑块”(低衰减斑块LAP负荷高)或血流储备不足(FFRct异常)的患者[15,16];新近发生急性冠脉综合征(ACS)或PCI术后患者(提示炎症活跃)的人群[17,18]。
总结
IPE(二十碳五烯酸乙酯)的价值不仅是降脂,更是“血管修复师”。REDUCE-IT研究提示,IPE通过降脂、稳斑、抗炎“三箭齐发”,直击心血管剩余风险。影像学和血流动力学证据(如斑块缩小、FFRct改善)更让它的作用“看得见、测得到”。对于他汀治疗后仍有隐患的患者,IPE是改写命运的重要利器。未来,我们期待这一利器惠及中国更多ASCVD患者!
专家简介

钱菊英 教授
复旦大学附属中山医院 副院长、心内科 副主任复旦中山罕见病诊疗中心主任国家放射与治疗临床医学研究中心 执行主任上海心血管病临床医学中心 副主任上海放射与治疗临床医学研究中心 负责人中华医学会心血管病学分会 常委中国医促会心血管病分会 副主任委员中国医促会心血管健康医学分会 副主任委员中国女医师协会心脏与血管专委会 副主任委员上海医学会心血管病分会 主任委员上海医师协会心血管内科医师分会 副会长上海医师协会内科医师分会 副会长
荆志成 教授
医学博士,主任医师,长江学者特聘教授广东省医学科学院 副院长广东省人民医院 心血管内科 行政主任2014年获“国家杰出青年科学基金”资助国家高层次人才特殊支持计划“万人计划”领军人才“百千万人才工程”国家级人选暨有突出贡献的中青年专家国务院政府特殊津贴荣获:吴杨奖、中国医师奖、树兰医学青年奖、北京优秀医师奖;以第一完成人荣获 中华医学科技奖一等奖、北京医学科技奖一等奖等主要学术兼职:
JACC 亚太区编辑HEART (The BMJ journals) Associate EditorJournal of Thrombosis and Haemostasis Associate EditorChinese Medical Journal Associate Editor中华心血管病杂志 副总编辑中国介入心脏病学杂志 执行主编中华医学会 心血管病学分会 常务委员兼 肺循环与右心学组组长比利时 FWO 弗兰德 基金 医学六部 (心、肺、肝、肾)专家组成员
郭远林 教授
中国医学科学院阜外医院主任医师心血管代谢中心副主任北京协和医学院医学博士、研究生导师、UCLA访问学者国家心血管病专家委员会心血管代谢医学专委会常务委员CDQI国家标准化心血管与代谢疾病中心秘书长中华医学会心血管病学分会代谢性心血管疾病学组委员北京高血压防治协会心血管代谢医学专委会常务委员海峡两岸医药卫生交流协会老年医学专委会委员中国女医师协会第三届心脏与血管专委会委员北京医学会心血管病学分会大数据学组委员中华康复医学心血管专业委员会委员中国医疗保健国际交流促进会动脉粥样硬化血栓疾病防治分会委员《中华高血压杂志》编委及多个国内外专业期刊杂志特邀审稿专家参考文献
[1] Bhatt DL, Steg G, Miller M, Brinton EA, Jacobson TA, Ketchum SB, et al. Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia. N Engl J Med. (2019) 380:11–22. 10.1056/NEJMoa1812792
[2] Sherratt SCR,Libby P,Budoff MJ, et al.Role of omega-3 fatty acids in cardiovascular disease:the debate continues[J].Current Atherosclerosis Reports,2023,25(1):1-17.
[3] Deepak L.Bhatt.EPA Levels and Cardiovascular Outcomes in the Reduction of Cardiovascular Events with Icosapent Ethvl-Intervention Trial.ACC.20/WCC media center.March 30,2020.
[4] aro I,et al.JAm Coll Cardiol.2020 Nov 3;76(18):2089-2097.
[5] Nelson J R , Budoff M J , Wani O R , et al. EPA's pleiotropic mechanisms of action: a narrative review[J]. Postgraduate Medicine, 2021.133(6):651-664.
[6]Nelson JR,Raskin S.The EPA/AA and its clinical utility in CVD.Postgrad Med.2019 May;131(4):268-277.
[7]Deepak L. Bhatt, MD,Emerging Pathways of Action of Eicosapentaenoic Acid (EPA) JACC: BASIC TO TRANSLATIONAL SCIENCE. 2025, 10(3):396 – 400
[8]Sherratt SCR, Libby P, Dawoud H, Bhatt DL, Mason RP. Eicosapentaenoic acid improves endothelial nitric oxide bioavailability via changes in protein expression during inflammation. J Am Heart Assoc. 2024;13:e034076.
[9]Mason RP, Libby P, Bhatt DL. Emerging mechanisms of cardiovascular protection for the omega-3 fatty acid eicosapentaenoic acid. Arterioscler Thromb Vasc Biol. 2020;40:1135–1147.
[10]Samuel C.R. Sherratt, et al. A Time to Tear Down and a Time to Mend”: The Role of Eicosanoids in Atherosclerosis. Arterioscler Thromb Vasc Biol. 2024;44:2258-2263.
[11]J. R. Nelson, S. Raskin.The eicosapentaenoic acid:arachidonic acid ratio and its clinical utility in cardiovascular disease. Postgraduate Medicine, 131:4, 268-277.
[12]Residual cholesterol and inflammatory risk in statin-treated patients undergoing percutaneous coronary intervention. Eur Heart J. Published online April 10, 2025. doi:10.1093/eurheartj/ehaf196
[13]J Am Heart Assoc. 2025 Mar 4;14(5):e038656. doi: 10.1161/JAHA.124.038656. Epub 2025 Feb 19.
[14]Lipids Health Dis. 2016 Jul 22;15(1):118
[15]Circulation. 2020 May 5;141(18):1452-1462.
[16]Rabbat MG, Lakshmanan S, Benjamin MM, et al. Benefit of icosapent ethyl on coronary physiology assessed by computed tomography angiography fractional flow reserve: EVAPORATE-FFRCT. European Heart Journal - Cardiovascular Imaging (2023) 00, 1-8.
[17]European Heart Journal (2024) 00, 1–4, https://doi.org/10.1093/eurheartj/ehad889
[18]Peterson BE, et al. .J Am Heart Assoc. 2022 Mar 15;11(6):e022937