在分子与细胞生物学实验中,质粒转染是一项基础且关键的技术。实验室长期开展相关研究,积累了多种转染试剂的使用经验,其中以“lipo”为名的系列产品包括赛默飞(Thermo Fisher)的Lipofectamine 2000与Lipofectamine 3000、百代生物的Lipofect 5000,以及碧云天的Lipo 6000与Lipo 8000。尽管名称相似,这些试剂在化学成分、作用机制及转染效能等方面存在显著差异。以Lipofectamine系列为代表的传统转染试剂主要依赖阳离子脂质体作为递送载体,而百代生物开发的Lipofect 5000则采用可生物降解的纳米材料作为递送系统。该类材料在显著降低细胞毒性的同时,仍能保持与Lipofectamine 3000相当的转染效率,展现出逐步替代传统脂质体或聚乙烯亚胺(PEI)类转染试剂的潜力。本文将从以下几个方面对Lipofect 5000的性能进行系统评述。
一、转染效率评估
转染效率是评估转染试剂性能的核心指标。本研究以常用的人胚肾细胞系AAV293为例,分别采用Lipofect 5000与Lipofectamine 3000进行绿色荧光蛋白(GFP)报告基因的转染实验。转染后24小时,通过荧光显微镜观察并比较荧光表达情况。结果显示,两种试剂在AAV293细胞中均能实现90%以上的转染阳性率,表明其在易转染细胞系中具有相近的高效转染能力。

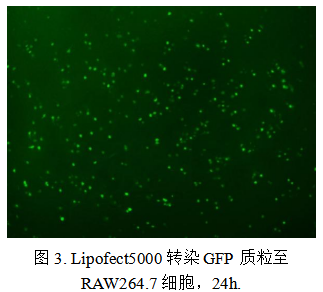
然而,优秀的转染试剂不仅应适用于易转染细胞,也需在难转染细胞中保持较高效率。以RAW264.7细胞为例,该类免疫细胞因兼具半悬浮生长特性及较强免疫原性,导致传统转染方法效率低下。本研究使用Lipofect 5000对传至第四代的RAW264.7细胞进行GFP质粒转染。实验采用含血清、不含抗生素的培养基铺板,待细胞融合度达80%时执行转染。24小时后观察发现,约70%的细胞呈现绿色荧光阳性信号,证明该试剂在该类难转染细胞中仍具备良好的递送能力。
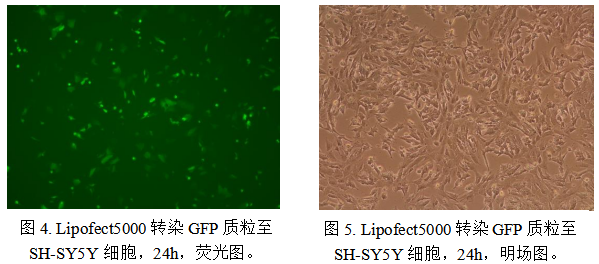
进一步地,我们在人神经母细胞瘤细胞(SH-SY5Y)中验证其转染性能。该细胞系转染难度较高,多数商业试剂转染效率仅介于10%–30%之间。实验结果显示,Lipofect 5000在该细胞中可实现超过50%的转染阳性率,显著优于常规脂质体类试剂,表明其在神经细胞等难转染模型中具有较好的适用性。
二、细胞毒性分析
除转染效率外,细胞毒性是评价转染试剂安全性与适用性的另一关键参数。与基于脂质体或PEI的传统转染试剂不同,Lipofect 5000采用可降解纳米材料制备,其在多次重复实验中所致的细胞死亡率与空白对照组无显著差异,表明其细胞毒性极低。这一点在转染脆弱细胞类型时尤为重要。以原代胃癌细胞为例,许多高毒性试剂易导致该类细胞死亡,即便如Lipofectamine 3000这类高效试剂,其固有毒性仍可能限制其在原代细胞中的应用。实验结果显示,Lipofect 5000在原代胃癌细胞中不仅可实现有效转染,且细胞状态保持良好,进一步证实其优异的生物相容性。

三、操作流程的优化与简化
实验操作的简便性及流程的稳定性也是选择转染试剂时的重要考量。传统脂质体类转染试剂常建议在转染前更换为无血清培养基,并于转染后4–6小时换回含血清培养基,旨在避免血清中带负电蛋白质与阳离子脂质体竞争结合DNA,同时降低由血清蛋白内化引起的细胞毒性。我们团队在使用Lipofectamine系列试剂时亦观察到血清存在对转染效率及细胞活性的负面影响。相比之下,Lipofect 5000因其非脂质体成分与低细胞毒性特性,在含血清条件下仍能维持稳定的转染效率,且转染后无需频繁换液,显著简化了实验步骤并提高了操作一致性。
此外,多数转染试剂在配制转染复合物时需依赖Opti-MEM或无血清培养基,而Lipofect 5000转染试剂中已预配专有的Trans buffer,不仅优化了复合物形成效率,也减少了研究者额外购买配套试剂的成本,对研究者更加友好,从实验成本看也更加经济。