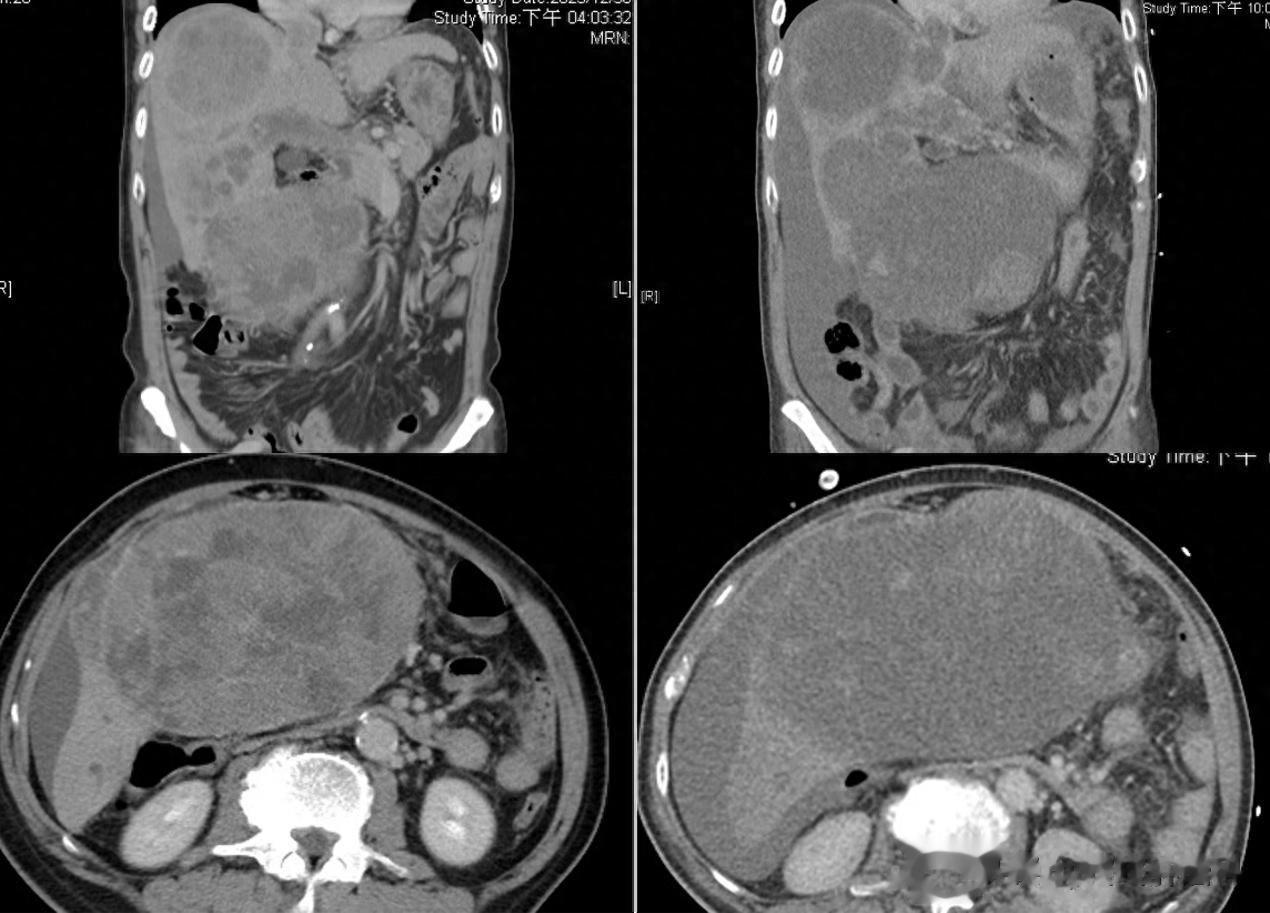
2023年,台湾省基隆长庚纪念医院接诊了一位巨块型肝癌患者,医生决定采用免疫+抗血管的治疗方案。然而就在首次治疗2天后,患者突然出现发热和心动过速,第3天进入休克状态,并同时出现了高尿酸血症、高磷血症、高钾血症、低钙血症和急性肾损伤,最终抢救无效死亡[1]。
造成这位患者死亡的并非是治疗无效,反而是疗效“过好”。影像学检查中,患者原本巨大的肝脏肿块已经快速消退,呈“空心”状态。而让患者死亡的正是因为肿瘤快速消退所导致的肿瘤溶解综合征。
 什么是肿瘤溶解综合征?
什么是肿瘤溶解综合征?肿瘤溶解综合征是癌症治疗中一种严重的代谢并发症,常发生在巨块型恶性肿瘤的治疗期间,有时也会因肿瘤生长过快自发发生。近些年来随着越来越多疗效更强的新疗法诞生,肿瘤溶解综合征的发生率也在不断升高。
肿瘤溶解综合征的发生,关键在于大量癌细胞坏死后,细胞内容物的集中释放。比如一块500g重的肿瘤,大约含有3200mg钾、2900mg磷,癌细胞的DNA代谢后还可以产生约5000mg尿酸,是一个人全身血液中钾含量的6倍,磷含量的24倍,尿酸含量的33倍[2]。

肿瘤溶解会释放大量的钾、磷和尿酸
如果肿瘤快速消退,这么多的钾、磷和尿酸短时间内释放到血液中,一方面会造成电解质平衡的紊乱,另一方面大量的尿酸还会在肾脏中结晶堵塞尿路、激活炎症,引起肾脏的急性损伤,让过多的钾、磷无法通过尿液排泄出去,进一步加重了电解质的紊乱,造成心律失常、癫痫、骨骼肌痉挛等后续并发症。
什么样的患者容易发生肿瘤溶解综合征?肿瘤溶解综合征的发生,和肿瘤的大小、类型,患者自身条件,应用的治疗方法都有关系。
在实体瘤中,大多数实体瘤发生肿瘤溶解综合征的风险都较低。但少数对化疗高度敏感的实体瘤,如小细胞肺癌、神经母细胞瘤等,有中等的肿瘤溶解综合征风险。如果这些癌症的患者再伴有肾功能障碍/肿瘤侵犯肾脏,风险将大大增加。
而在治疗方法上,慢性淋巴细胞白血病的特效药维奈克拉的肿瘤溶解综合征风险需要特别注意。此外,FDA药物警戒数据还显示硼替佐米、达雷妥尤单抗、双特异性抗体和CAR-T疗法引发肿瘤溶解综合征的风险较高,免疫检查点抑制剂的肿瘤溶解综合征风险则较低[3]。
怎样预防肿瘤溶解综合征?预防肿瘤溶解综合征的关键在于保护患者的肾功能,让患者能通过尿液排出肿瘤溶解释放的有害物质,核心的预防措施有两条:
多喝水降尿酸多喝水可以增加尿量,稀释肿瘤溶解释放的有害物质,减少尿酸和/或磷酸根在尿路中的沉积。《美国肿瘤溶解综合征预防和管理专家共识指南》推荐,开始任何存在肿瘤溶解综合征风险的癌症治疗前,患者每日饮水量应该达到2~3L/㎡(体表面积)。
而降尿酸也可以减少尿酸的沉积,保护肾功能,但是不建议采用碱化尿液的方式,因为这会增加磷酸钙沉积的风险。可以选择别嘌呤醇、拉布立酶等其它降尿酸疗法。
此外,控制治疗强度,提前减灭部分癌细胞等方法也有助于避免肿瘤溶解综合征的发生。
在癌症新疗法日新月异的今天,更好的癌症治疗效果也给肿瘤溶解综合征的管理带来了新的挑战。希望每位癌症患者在治疗期间都能做好肿瘤溶解综合征的预防和监测,让新疗法优异的疗效充分转化成更高质量的生活。
参考文献:
[1].Chou T S, Wu C F, Lin C L, et al. Case Report: Tumor lysis syndrome in advanced, massive hepatocellular carcinoma with main portal vein invasion following atezolizumab plus bevacizumab therapy[J]. Frontiers in Oncology, 2025, 15: 1624908.
[2].Howard S C, Avagyan A, Workeneh B, et al. Tumour lysis syndrome[J]. Nature Reviews Disease Primers, 2024, 10(1): 58.
[3].Bociek R G, Lunning M. Tumor Lysis Syndrome[J]. New England Journal of Medicine, 2025, 393(11): 1104-1116.