
近日,《通讯医学》发布了一篇名为《早期大流行性HIV-1整合位点偏好因解剖部位而异》的文章。
这项研究揭示了HIV如何在不同组织中以不同方式“藏身”,并非随机整合入人体DNA,而是根据所在环境选择潜伏位置。研究人员利用上世纪HIV/AIDS疫情早期的珍贵组织样本,首次在多个器官中观察到病毒的自然分布,发现它会因组织差异而调整潜伏策略。
这一发现不仅帮助解释了HIV长期难以根除的原因,也为未来开发能精准清除或“沉默”潜伏病毒的治疗方法提供了新思路。
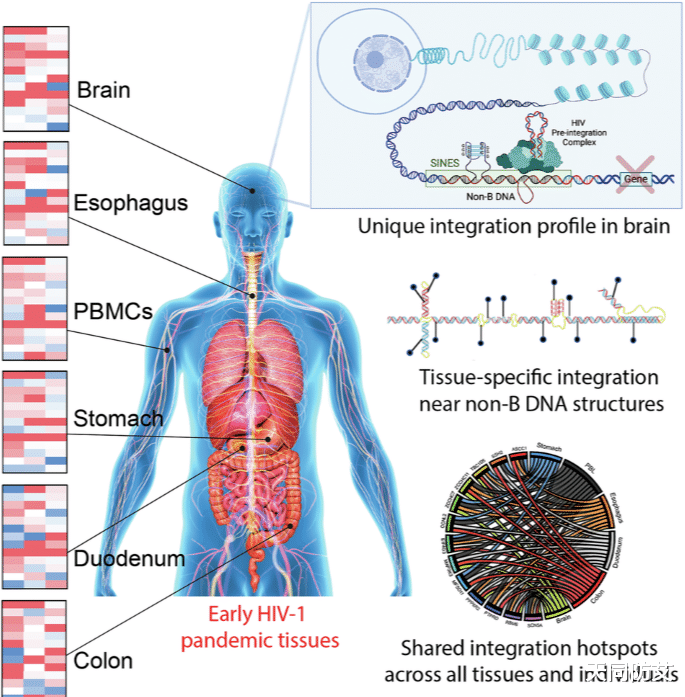
病毒如何嵌入宿主DNA?

艾滋病病毒(HIV)之所以难以彻底根除,症结在于其高超的“潜伏”能力。即使现代抗逆转录病毒药物(ART)能有效抑制病毒,一旦患者停药,休眠的病毒就可能迅速复苏。
近日,一项由加拿大西安大略大学和卡尔加里大学研究人员主导的最新研究,揭示了HIV病毒潜伏的核心秘密:它在人体的不同组织中,会采取截然不同的“安营扎寨”策略。这一发现,被视为未来开发靶向疗法、彻底清除病毒的关键一步。
在潜伏期,HIV会变成休眠的“前病毒”(provirus),将自己的基因组永久性地嵌入宿主细胞的DNA中。这些深藏不露的病毒“残迹”是目前ART药物无法触及的,迫使患者不得不终身服药。
此前的研究已确认,病毒可以潜伏在多种组织和细胞类型中,包括血液中的辅助性T细胞、肠道,甚至是大脑。但科学家一直不明白,病毒是如何在如此多样化的环境中立足的。
这项发表在《通讯医学》(CommunicationsMedicine)杂志上的研究,通过分析早期HIV/AIDS疫情时期收集的罕见组织样本(包括血液、食道、胃、十二指肠、结肠和大脑),发现病毒的整合模式并非随机,而是高度组织特异性。

大脑区域潜伏模式大不同

研究人员对病毒整合入宿主基因组的频率进行了详细分析,发现不同组织间的整合模式存在显著差异:
大脑的独特策略:在大脑组织中,HIV表现出明显的“避开活跃区”的倾向。病毒更少整合到活跃的基因区域中,而是更频繁地藏匿在相对沉寂的重复元件(SINEs)和可接近的DNA区域(DHS)中。
科学家推测,这可能是因为大脑细胞中缺乏指导HIV整合入活跃基因的关键蛋白LEDGF/p75,以及存在更多能将病毒推向不活跃区域的抗病毒蛋白APOBEC3。这种策略有助于病毒逃避免疫系统的监视和清除。
其他组织的共性:相比之下,血液和胃肠道(食道、胃、结肠等)组织虽然也有一些差异,但整体上保持了相似的整合模式,通常更偏向于活跃的基因区。

存在共享的“长期庇护所”

尽管存在组织差异,但研究也发现了一个惊人的现象:
热点重叠:研究发现,有超过17%的病毒整合位点在不同的组织间是共享的,甚至有近19%的位点在不同的感染者个体间也是共享的。这有力地证实了HIV并非随机整合,而是高度精准地靶向某些基因组区域。
超级热点:一个名为TBC1D5的基因位点,在所有受试者的组织中都出现了整合。这表明特定的基因区域可能作为病毒的“超级庇护所”,在不同个体和组织中都非常适合病毒的长期潜伏。
疾病关联:研究还发现,HIV整合位点常位于与癌症、心血管疾病和神经系统疾病相关的基因附近。这引发了一个重要问题:HIV的这种整合是否会通过破坏基因功能,从而导致艾滋病相关并发症的发生?
历史样本,未来希望

研究团队强调,这项工作得以完成,得益于早期HIV/AIDS流行期间收集并保存的罕见组织样本。
“这些志愿者在治疗有限、充满污名和恐惧的时期愿意提供样本,展现了勇气和远见,”卡尔加里大学的分子病毒学家GuidovanMarle表示。
研究的另一位作者、微生物学家StephenBarr总结道:“我们的研究表明,HIV遵循各组织特有的模式,这些模式可能受到局部环境与免疫反应的影响。弄清病毒在基因组中的确切潜伏位置,有助于我们用针对性疗法攻击这些细胞和组织——无论是彻底清除它们,还是永久让病毒保持沉默。”
这项发现为未来的艾滋病治愈研究指明了方向:要彻底清除HIV,不能再将全身的病毒库视为一个整体,而必须针对不同组织的独特潜伏策略,开发出“因地制宜”的靶向治疗方法。
文章标题:Early pandemic HIV-1 integration site preferences differ across anatomical sites
作者:Hinissan P. Kohio, Hannah O. Ajoge, Emile A. Barua,et al.
DOI: 10.1038/s43856-025-01146-5
编译:松鼠哥