家里面如果有父母患癌了,对于这个家庭来说打击是致命的,尤其是子女不免担心自己是否也会患癌。那么癌症,到底是不是基因注定的,哪些癌症或会传给下一代呢?
 一、癌症是基因注定的,躲也躲不掉?
一、癌症是基因注定的,躲也躲不掉?很多人一提到癌症,不免色变,但很少人知道它到底是怎么来的。实际上,就是原本正常的细胞,不再遵循常规的生长规律,走上了异常的变化之路。然后不停的增殖复制,增殖再复制,它们会抢夺正常细胞的营养,引起全身的免疫反应。接着就是正常细胞的衰退,相应的这些异化后的细胞不断扩张增殖。最后,影响到全身多器官的正常功能,使它们发生病理学的衰竭。
那为什么这些细胞会出现异化呢?这就要从基因说起了。
我们常说的基因是储存在我们细胞核内DNA链上的遗传指令,它们决定了我们从头发颜色到身体代谢方式的几乎所有方面,每天我们的体内会有数以亿计的细胞进行分裂,而每一次的分裂都会有基因在被复制。

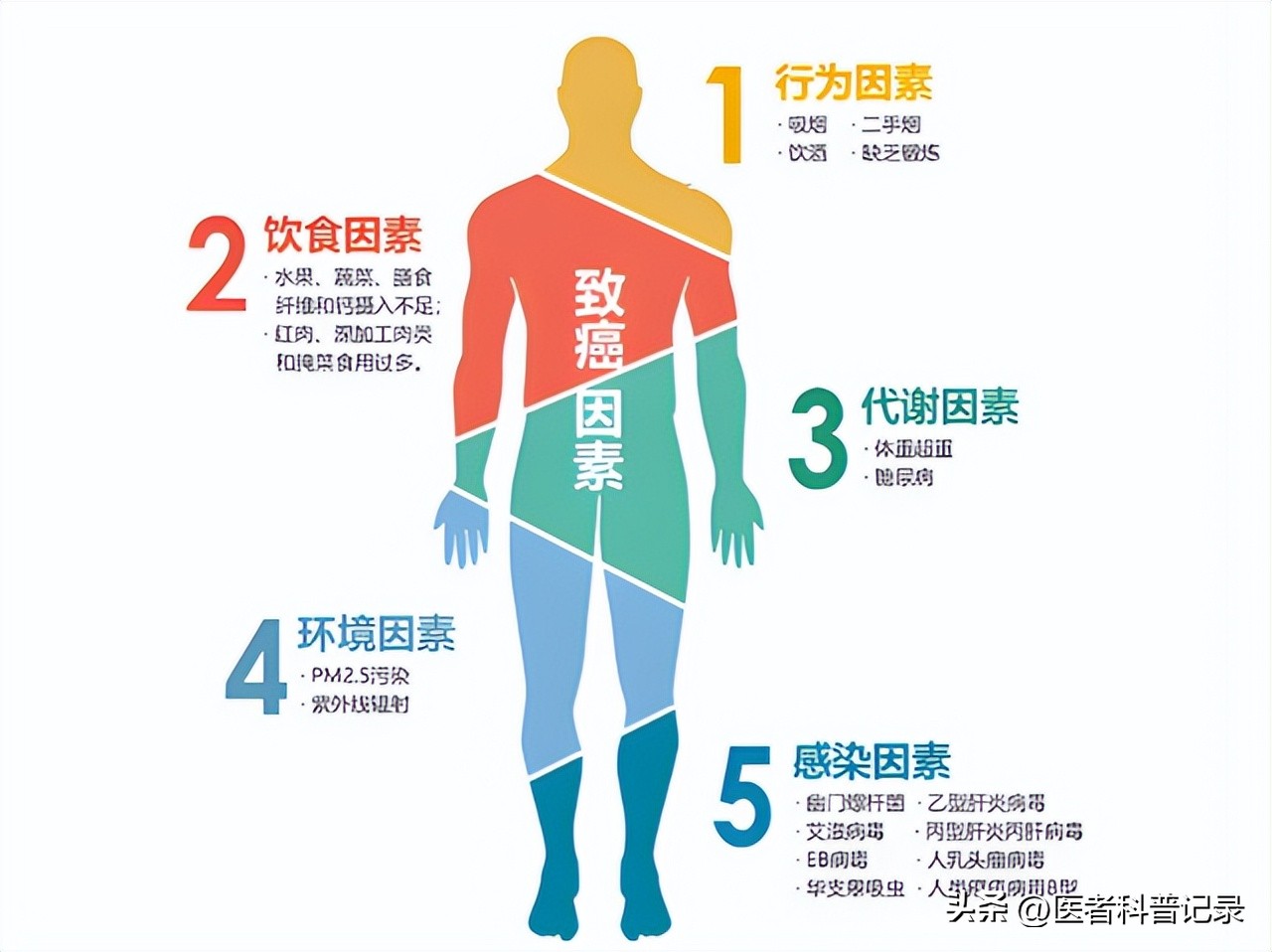
目前生物学研究中发现,绝大多数癌症(约90%-95%)的发生,主要源于体细胞中随机累积,以及各种不良环境因素的影响。
就比如在这个复制的过程中,一些聚合酶不是很精确,难免就会出现一些随机错误,就像中彩票一样,基因突变它就发生了。当然,干细胞分裂越频繁的组织(如结肠、皮肤),那发生这种错误的可能性也就越大,癌症风险相对来说也就更高。
同时,像烟草烟雾、紫外线、X光的辐射、化学物质(如石棉、苯)、病毒(如HPV、乙肝病毒),以及身体长期处于慢性炎症状态等情况,都会不断的攻击我们的DNA,造成损伤。大多数时候细胞可以通过修复这些错误,或是通过让那些出现了问题的细胞死亡再生等方式,来清除这些损伤比较严重的细胞。
但极个别情况下,一些受损的DNA就可能会逃脱掉清理,并在细胞中累积起来,慢慢的也就会突变。一般情况下,一个突变要想成为漏网之鱼是需要过很多生物学门槛的,这个过程可能需要几年甚至几十年。
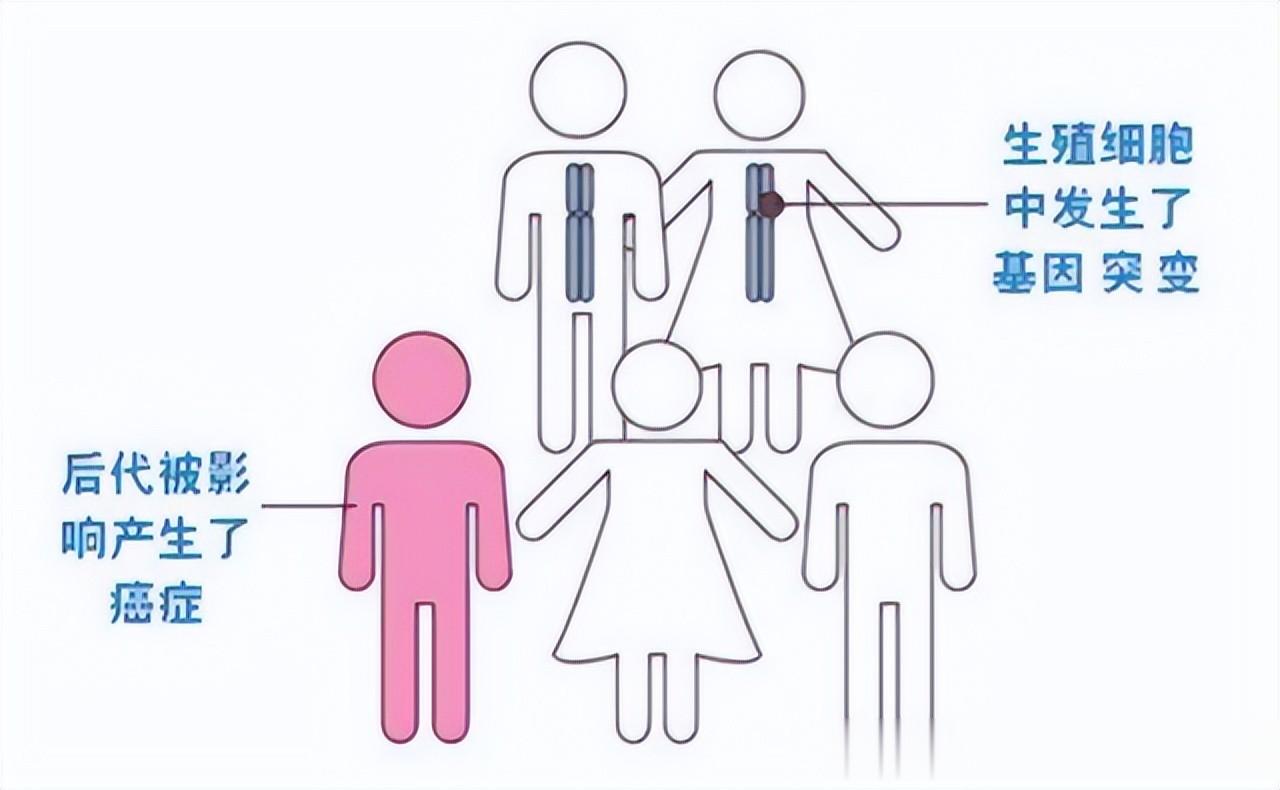
不过,这些错误的基因一般有10%左右是具有明显的遗传倾向的,就比如可能会是从父母一方或双方遗传而来的,就是精子或是卵子的时候这些突变基因就已经存在了。而当它们结合之后,开始正常分裂生长的过程中,每一个细胞里面都会存在这类突变。那如果是携带了这类基因的人群,自然一生中罹患特定癌症的风险,就会比普通的人群高很多倍。假如是从这个角度来说的话,那这部分的人确实是与生俱来的患癌高风险人群,不过也不是说拥有高风险基因突变就代表着癌症必然发生,它只是概率更高而已。
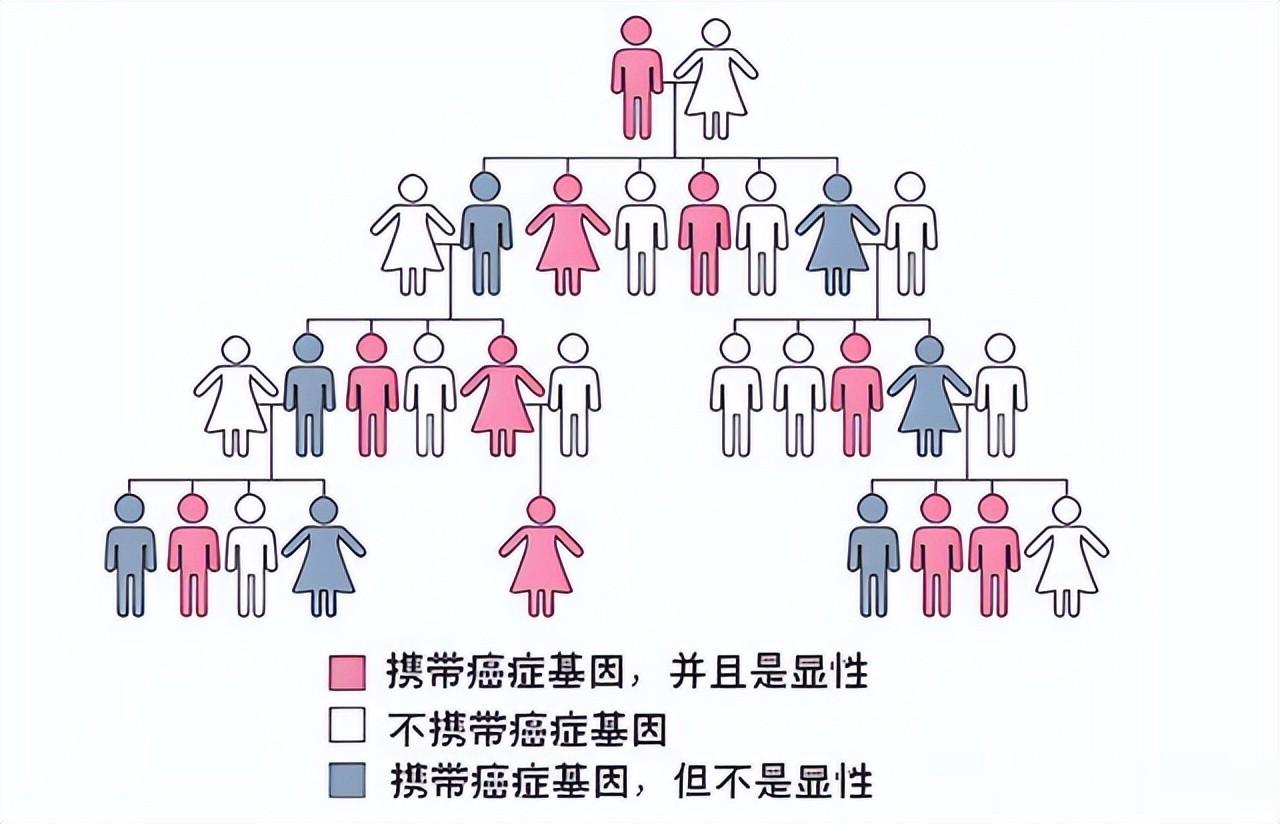 二、父母若患4种癌,或会传给下一代
二、父母若患4种癌,或会传给下一代第一种:乳腺癌
尽管九成左右的乳腺癌是散发性的,但仍有约一成的病例具有明显的遗传倾向,这类患者的发病年龄一般都会比非遗传性的早十几二十年,尤其是家里已经有母亲或是直系的姐妹被确诊为乳腺癌的时候。
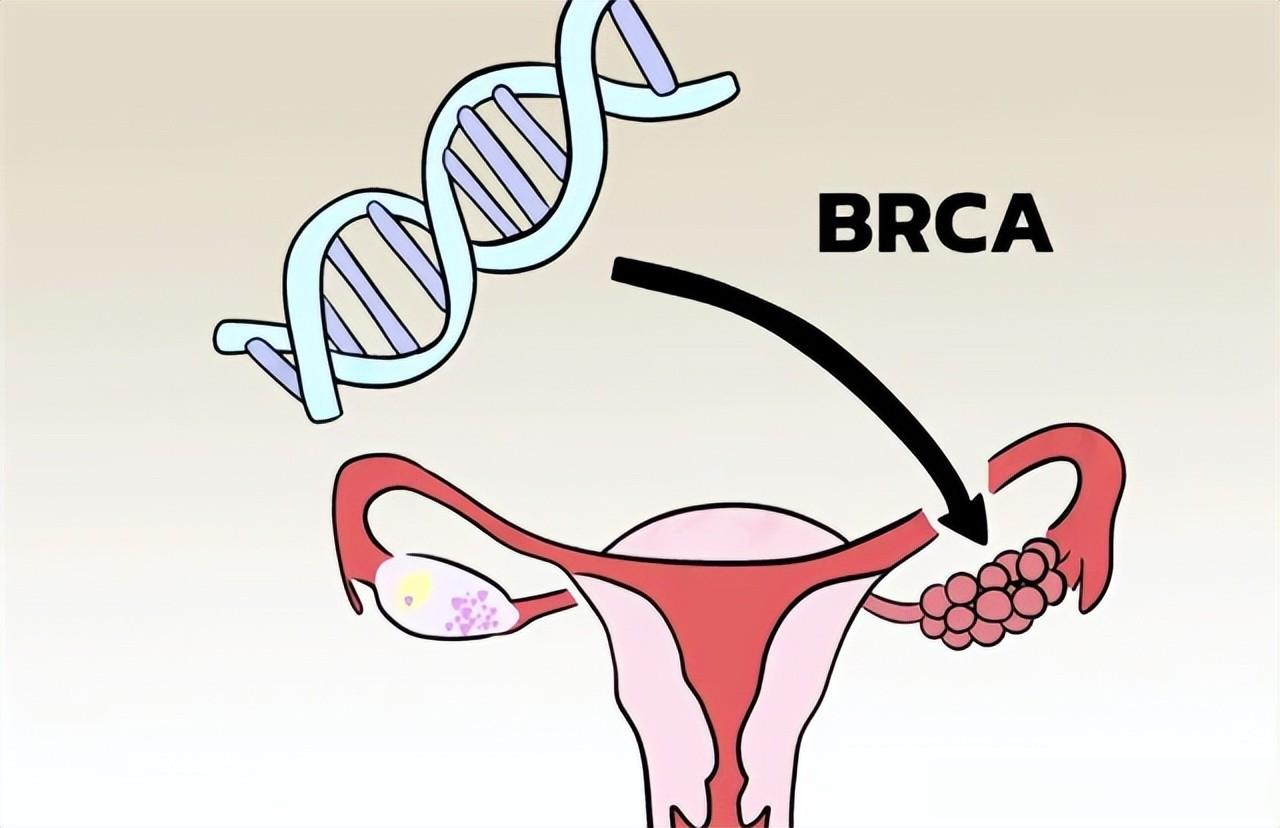
在我们的身体里面有负责修复DNA损伤的基因(如BRCA1、BRCA2),如果一个人从父母一方遗传了一个出问题的此类基因,那体内所有细胞的修复能力就会存在先天缺陷。刚好在生命历程中某个细胞(如乳腺细胞)在正常的基因拷贝过程中出现了问题,那该细胞就完全没有修复功能了,问题基因就会快速的积累,自然最后出现癌症的风险就会大大增加。
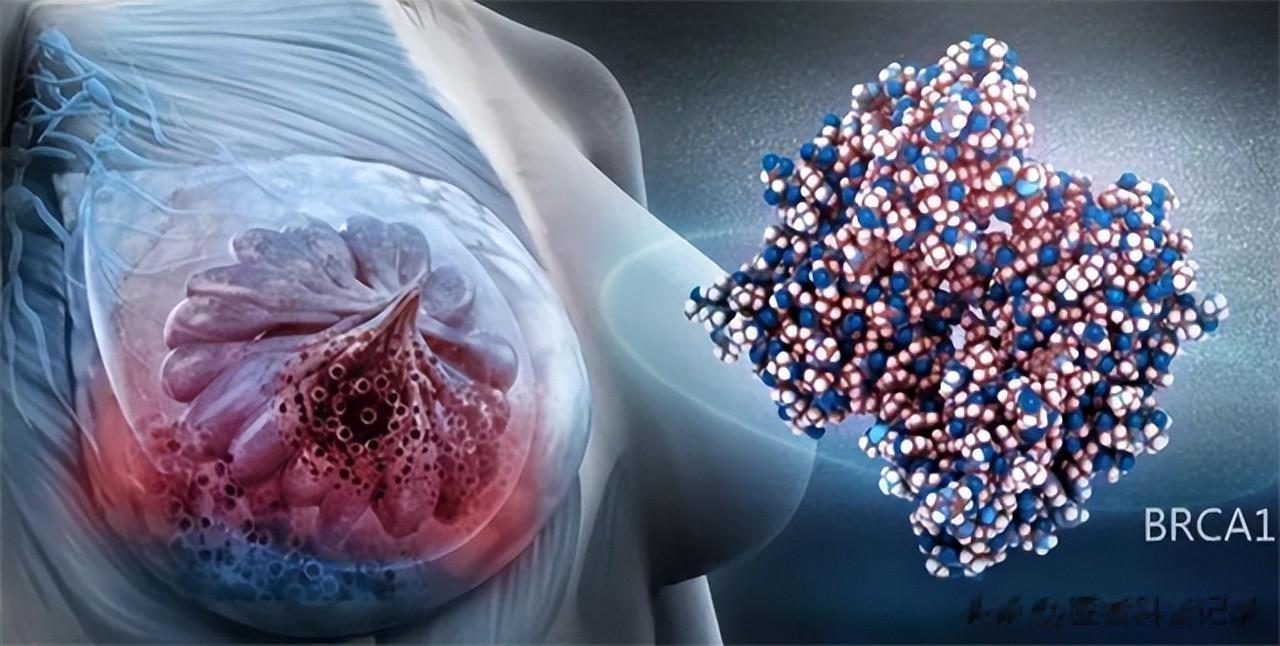
研究发现,此类携带者一生中患此类癌症的风险最高可达80%(非携带者女性约为12%)。而且,男性也不要大意,因为男性携带者同样也会面临更高的乳腺癌和前列腺癌风险。
除了BRCA基因,其他如TP53、PTEN、PALB2、ATM等基因的致病突变也会在不同程度上增加乳腺癌的患病风险。
如果在上下三代中出现多位近亲患癌,尤其是直系亲属中有两人以上患乳腺癌的;或是早发性癌症(即亲属在50岁前确诊);以及出现过像双侧乳腺癌或男性乳腺癌这类比较特殊的癌症类型;或是同一家族中出现乳腺癌、卵巢癌、胰腺癌或前列腺癌等多种相关癌症聚集的情况,那就要高度警惕遗传的可能性了。
所以说,对于这类高风险人群,建议从25岁左右就开始加强筛查。最好是每半年到一年之间要进行一次的乳腺超声检查,并从30岁起每年增加磁共振检查。
已完成生育的女性的携带者,也可以在医生的综合测评后,根据现有风险可以考虑药物预防(如他莫昔芬)或预防性手术(如双侧乳腺切除术,可降低90%以上风险)。
第二种:卵巢癌
卵巢癌,它同样是来自于这两个基因突变。相关研究显示,这两种基因突变的携带者到七十岁的累积风险最高可达到55%-60%,且发生转移的风险更高。
相比来说,它的遗传性风险甚至会更高,约五分之一的最常见上皮性卵巢癌都是与之相关的。同样,它的发病年龄也会更早,而携带者终生罹患癌的风险会从普通人群(1.4%)升高数十倍。同时,还有像MLH1、MSH2、RAD51C、RAD51D、BRIP1等基因的突变,也会使此类癌症的风险增加约10%-15%。
所以,如果三代之内多出多么此类癌症患者;同时出现卵巢癌、结直肠癌、子宫内膜癌等多种相关癌症的情况;或是存在与乳腺癌并存的;又或是有早发癌症的都需要警惕遗传这个问题。
这些风险较高的人群,建议可以从30岁开始,每半年到一年中间至少要进行一次阴超,如果是确定突变,最有效的干预就是预防性手术。
对于已完成生育计划的携带者,在推荐年龄(如BRCA1携带者约35-40岁,BRCA2携带者约40-45岁)可以考虑进行预防性的双侧输卵管—卵巢切除术(可降低80%-90%的患癌风险)。
即便是没有做基因检测,对于有高危因素风险的人群来说,如果日常出现不明原因的腹痛、腹胀,并且在常规药物治疗后没什么效果的,也建议及时进行相关检查。
第三种:结直肠癌
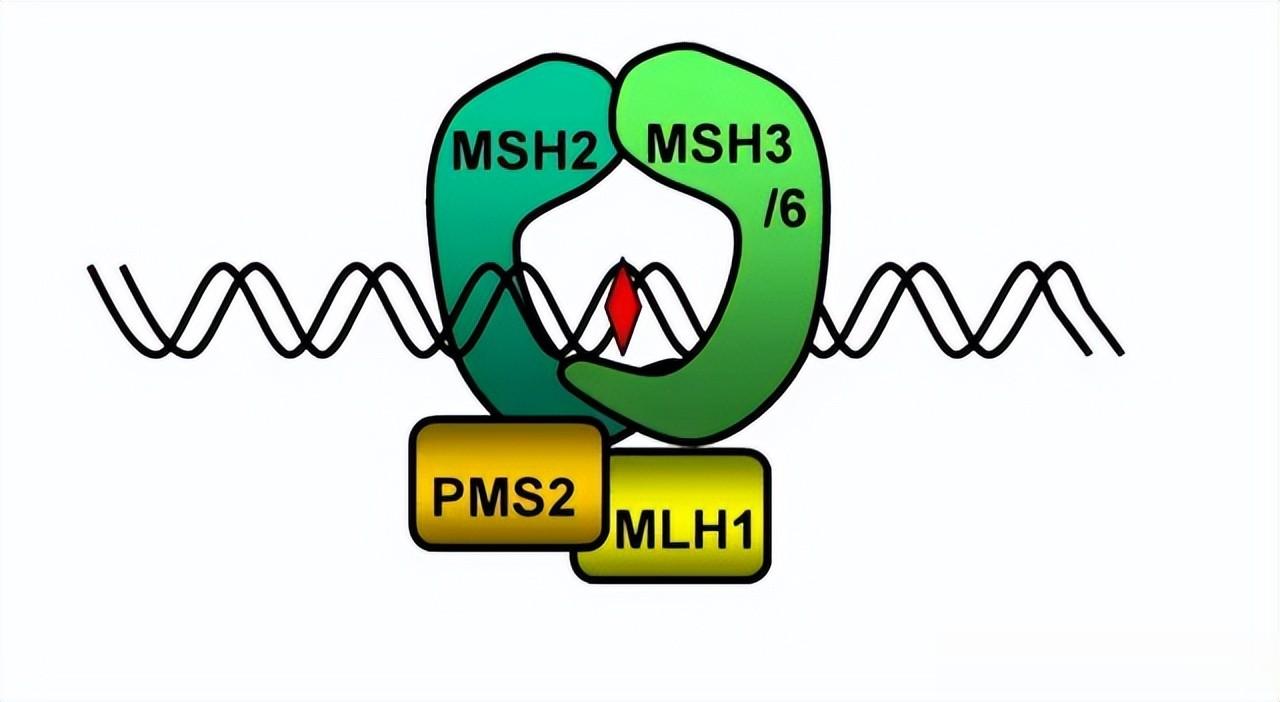
结直肠癌,则主要是与一些纠正和修复受损细胞的基因(如MLH1、MSH2等)出现问题相关,它们功能受损同样会使错误快速积累。数据显示,携带此类基因的人群,一生中患此类癌症的风险最高可达80%,平均发病年龄在45岁左右(比普通人群提前约20年)。
同时,它还与APC基因的突变有关,此类人群一般在青少年时期的时候,肠道内就可能长出数百上千个息肉,如果不在早期进行合理的干预,这些息肉几乎必然在中年之前发生癌变。
同样的,如果三代之内存在多名亲属都患有相关的癌症,尤其有人在50岁之前确诊的;或是有年轻的成员被发现肠道内有大量息肉;或相关癌症连续在两代甚至三代中都有出现的,那就要警惕遗传的可能性了。
建议有此类基因携带者,最好是要比最早发病的亲属年龄还要提前5年,就开始每年进行一次结肠镜检查,女性还需定期进行子宫内膜和卵巢检查。如果是APC基因突变,那就需要从10左右开始每年进行结肠镜筛查,并在在20岁左右(息肉大量出现的时候),考虑进行预防性全结肠切除术。即使没有进行基因检测,有明确家族史的人群,也应比普通人群(45岁)更早的开始进行结肠镜筛查。
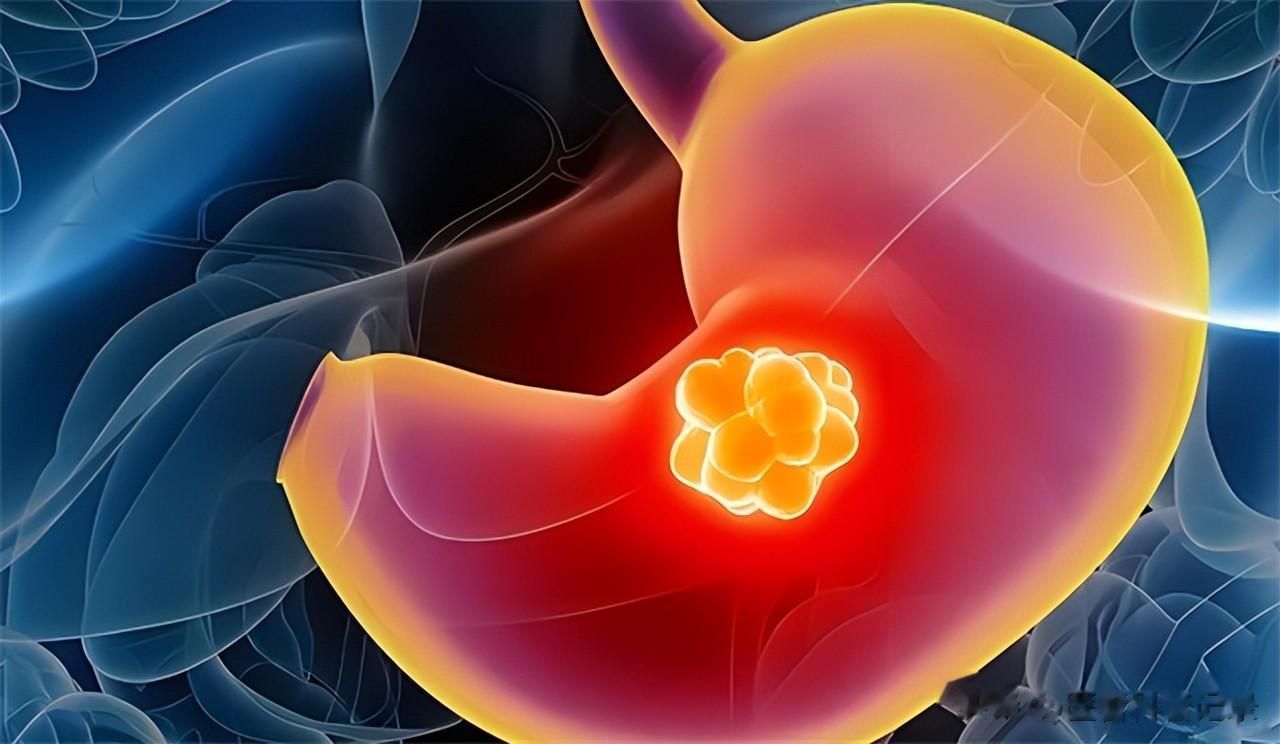
第四种:胃癌
在临床上,胃癌也很容易发生家族聚集性,其中约一成的患者会有明确的遗传综合征,它主要也是特定的基因突变会从根本上降低胃黏膜细胞的稳定与修复能力,使其在幽门螺杆菌(HP)感染等因素的共同作用下,更容易发生癌变,且此类癌种常常更具有侵袭性。
以CDH1为例,此基因所编码的E - 钙黏蛋白,在维系胃黏膜正常结构方面意义重大,对保障胃部组织的稳定与健康起着关键作用。当个体遗传了CDH1基因的致病突变,全身细胞制造此类蛋白的能力就会存在天生缺陷,就会使胃壁细胞粘附不牢,出现异常的增殖,最终就可能发展为呈弥漫性生长的细胞癌。
临床显示,携带此突变者,终生患病的风险很高(其中男性约67%,女性约83%),且女性携带者罹患小叶乳腺癌的风险也很高。
所以,如果三代之中有两名或以上相关癌症患者,尤其有人确诊为弥漫型,或在50岁前发病的;或是存在弥漫性胃癌和小叶乳腺癌并存的亲属的;以及在多代亲属中连续出现相关癌症的,都都要警惕遗传性基因问题。
对于那些已经确定了属于突变携带者的人群,建议从成年后便开始每年进行一次高清染色内镜联合随机活检,当然目前最有效手段依然是手术干预,即在20岁到30岁之间进行预防性全胃切除术。
即便情况尚未明确,但对于高危人群而言,建议自30岁起,每年开展一次胃镜检查,以便及时察觉潜在隐患。同时,对所有直系亲属都应该进行幽门螺杆菌的筛查与根除,这也是降低胃癌发生比较有效的方式。
不过,即便是家里出现了这样的情况,也不要灰心,不要误以为父母有癌就一定会遗传给子女。假如是一个具有可遗传性基因的人,后天又长期暴露于强致癌环境(如吸烟、不良饮食、缺乏运动),那随着这些驱动突变因素的累积,患癌可能是必然的。但是,如果后天保持健康体重、规律运动、均衡饮食、限制烟酒、接种HPV和乙肝疫苗、防晒以及减少职业致癌物暴露等,那患癌只是风险高,而并非必然。

总而言之,癌症的发生,可能是基因后天在细胞分裂增殖过程中出现了小概率性错误,也可能是后天受各种可致癌因素(如x射线、化学污染等)造成的,还有可能是先天遗传的。
如果家里父母有患乳腺癌、卵巢癌、结直肠癌、胃癌的,那子女在未来患癌的风险要比普通人群高出数倍。
所以,如果家里面有父母患癌,建议尽早的到专业医院进行相关筛查,即便真的不幸中招,也可以在早期早发现,更有利于预后健康。
参考文献:[1]叶秀美,陈韵如.基因检测基本原理与癌症遗传谘询[J].Dubai Medical Journal, 2018(2):19-26.
[2]刘娜,王临池,胡一河,等.一级亲属癌症史对胃肠道癌症的遗传倾向影响[J].上海预防医学, 2018, 30(12):5.DOI:10.19428/j.cnki.sjpm.2018.18974.
[3]杨晓晨,胡震,吴炅,et al.中国汉族人群中BRCA1和BRCA2基因突变携带者患乳腺癌风险的研究[J].中国癌症杂志, 2015, 25(4):6.DOI:10.3969/j.issn.1007-3969.2015.04.002.