2024年2月16日,美国食品药品监督管理局(FDA)批准了首款TIL细胞疗法AMTAGVI™(lifileucel)上市,用于PD-1/PD-L1治疗后进展的晚期黑色素瘤。这一突破为癌症患者带来了更多希望和另一次机会。
关于TIL细胞疗法
TIL细胞疗法是一种开创性的治疗方法,利用患者自身的免疫细胞来对抗癌症。医生会切除患者肿瘤的一小块,并从中采集一种特殊的免疫细胞,称为肿瘤浸润淋巴细胞。这些细胞随后在实验室中培养,直到数量达到数十亿。这些细胞随后在一次治疗中输注到患者体内。由于TIL使用患者自身的肿瘤浸润淋巴细胞,该疗法针对患者的癌症量身定制免疫攻击。
多年前,转移性黑色素瘤患者几乎没有治疗选择,生存率通常以几个月为单位。如今,许多患者因免疫疗法而活得更久。现在,对于那些未能缓解的人来说,TIL疗法为他们提供了另一条强有力的前进道路。

骨髓移植与细胞治疗系副教授Rashmi Khanal医学博士表示“这是一种高风险、高回报的疗法,对于那些可能觉得已经没有选择的患者,TIL疗法可以带来真正的希望。”
临床数据显示,Amtagvi(lifileucel)对既往接受过免疫检查点抑制剂(ICI)治疗的晚期不可切除或转移性黑色素瘤患者具有显著疗效:客观缓解率达到48.8%,将近一半的患者肿瘤缩小或消失。
TIL疗法的高昂费用及其副作用
虽然lifileucel已经获批上市,但售价51.5万美元,折合人民币约高达370万,高昂的费用让很多患者望而却步。
并且,由于接受TIL细胞回输之前,患者需要接受化疗和白细胞介素2(IL-2)治疗。这也是TIL细胞疗法的不足之处。化疗会出现严重副作用,包括恶心和呕吐,白细胞数量也会下降,这会使患者面临很高的感染风险。
IL-2,即白细胞介素2,是一种较老的药物。许多接受IL-2治疗的患者出现发烧、颤抖、发冷和低血压。IL-2会导致毛细血管渗漏综合征,即液体从血液中渗漏到手脚,导致肿胀。液体还会进入肺部,导致患者需要氧气。血压下降和液体渗漏的结合会损害肾脏。这些副作用同样限制了TIL细胞疗法的临床应用。
国产TIL细胞疗法蓬勃发展
为了让更多患者用得起、用得上TIL细胞疗法,我国君赛生物研发了无需高强度清淋化疗,也无需大剂量IL-2支持的TIL细胞疗法-GC101,这款细胞疗法可显著提高治疗安全性。
临床数据显示:GC101在非小细胞肺癌中的疾病控制率(DCR)为66.7%,客观缓解率(ORR)为41.7%。
不仅如此,GC101在胰腺癌等其他实体瘤中也具有显著疗效。11月20日,GC101在晚期胰腺癌患者的临床试验中取得了积极成果,并分享了一个成功案例。
患者M先生被诊断为胰腺癌。胰腺癌素因其早期诊断率低、死亡率高、易于转移、治疗困难,常被称为“癌王”。尽管M先生接受了手术切除病灶,但肿瘤仍旧复发并且出现了肝内转移。
走投无路之下,M先生选择接受前沿治疗,毅然加入君赛生物研发的TIL细胞产品(GC101)的临床试验项目。
幸运的是,M先生的选择是正确的。在单次回输TIL细胞仅仅6周后,影像学检查显示,他胰头部位的复发病灶从10厘米迅速缩小至3厘米,而肝脏内的转移灶则已完全消失。更令人欣喜的是,多项肿瘤标志物也恢复至正常水平。在那之后的多次检查中也发现病灶仍在不断缩小,最终稳定在1厘米左右。截至目前,M先生已摆脱病痛折磨,恢复正常生活超过39个月。

图片源于君赛生物
除了GC101,国内自主研发的TIL疗法如沙砾生物的GT101、GT201、GT300,百吉生物的BST02以及华赛伯曼的HS-IT101等,在黑色素瘤、卵巢癌、头颈癌、宫颈癌、肝癌等治疗中同样显示出巨大的潜力,为实体肿瘤患者带来了希望。
GT101与宫颈癌
GT101是中国首个进入临床的TIL产品,GT101治疗宫颈癌的I期临床数据结果显示:11例宫颈癌患者中有1例患者达到完全缓解(CR),4例患者部分缓解(PR),疾病控制率(DCR)为90.9%。
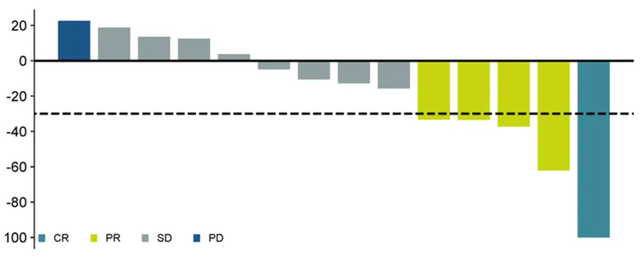
值得一提的是,一名患者获得了持续14.5个月的完全缓解(CR)。该患者被诊断为IIIC2期宫颈鳞状细胞癌,并接受了转移淋巴结的手术切除。在治疗前,基线时的肿瘤总和直径(SOD)为71.57mm,在治疗28天后降至29.12mm。在GT101治疗后第12周,影像学检查证实了肿瘤完全消退(CR)。
BST02注射液与肝癌
BST02注射液是全球首个针对肝癌(包括肝细胞癌和胆管癌)的TIL细胞产品。研究中,队列1中的3名患者和队列2中的2名患者成功制造了TIL。
在队列1中,有3名患者,其中2名进行了基线和输注后疾病评估。BST02显示了100%(2/2)的疾病控制率(DCR)和50%(1/2)的客观反应率(ORR)。在反应最佳的患者中,观察到多处病变持续显著缩小。具体来说,输注后84天,肝脏多处靶病变减少了57.1%,门静脉肿瘤血栓减少了51.8%。
HS-IT101与黑色素瘤
华赛伯曼自主研发的FAST-TIL产品(HS-IT101注射液)在针对晚期黑色素瘤的10例可评估患者中1取得了40%的客观缓解率(ORR),其中1例完全缓解(CR),3例部分缓解(PR),疾病控制率(DCR)更是达到了惊人的100%。尤为值得一提的是,这个40%的客观缓解率,已经显著超越了目前全球唯一获批的TIL产品Lifileucel(Amtagvi)在其关键临床试验中报告的31.4%的缓解率。在更新的数据中,1例部分缓解(PR)和1例病情稳定(SD)患者已经转化为完全缓解(CR)和部分缓解(PR)。

这些数据生动证明了国内TIL细胞疗法的蓬勃发展以及积极的治疗效果。
结语
2024年2月FDA批准首款TIL细胞疗法上市,不仅是科学技术的重大突破,更是癌症治疗理念的重要转变。从传统的化疗放疗到靶向治疗,再到如今的细胞免疫治疗,我们正见证着癌症治疗领域的革命性进步。
虽然TIL疗法仍面临诸多挑战,但其巨大的潜力和已经显现的临床价值,让我们有理由相信,这项技术将为更多癌症患者带来希望。随着技术的不断发展和完善,TIL细胞疗法有望成为癌症治疗的重要支柱,为人类战胜癌症的征程贡献重要力量。未来,我们期待看到更多创新疗法的涌现,为全球癌症患者带来福音。