奎因·约翰森(Quinn Johnsen)是多伦多一位工业设计师,也是滑雪场上的常客。2020年,奎因·约翰森的生活被滑膜肉瘤给打破。但幸运的是,在历经重重磨难后,约翰森的生命正奇迹般地回到了正轨,这背后离不开TCR-T细胞疗法的付出。
什么是TCR-T细胞疗法?
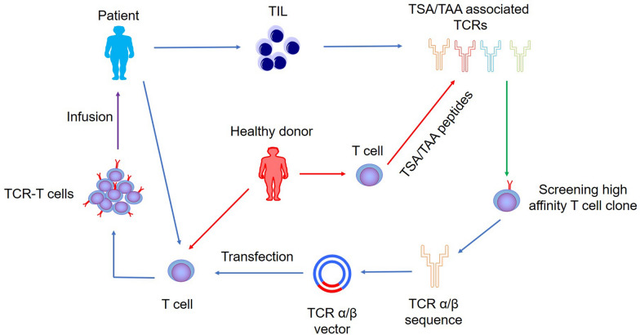
TCR-T细胞疗法是一种创新的癌症免疫疗法,它对患者的T细胞进行基因改造,以表达特定的TCR,这些TCR识别癌细胞上主要组织相容性复合体(MHC)呈递的肿瘤相关抗原,以靶向并破坏癌细胞。
TCR-T与HLA
在细胞内,蛋白质通过蛋白酶体不断降解和回收,蛋白质被切碎成更小的肽序列,这些肽序列被主要组织相容性复合物(MHC,在人类中称为人类白细胞抗原HLA)捕获。这种复合蛋白体将向细胞膜移动,一旦HLA在“肽段自助餐”中完成取样后,它就会将这些片段运送至细胞表面,供巡逻的T细胞检测。T细胞正是通过这些“肽段开胃菜”来甄别蛋白质来源的正常与否。

1990年代末期,科学家们已找到方法筛选能表达特定结合特性TCR的人类T细胞,并将TCR基因转移至新T细胞中,从而重编程其攻击靶标。
正因为TCR-T细胞的抗原识别仅限于呈现表位的人白细胞抗原(HLA)等位基因,从而限制了可以从给定的TCR-T细胞疗法中受益的患者数量。也就是说,要使TCR-T疗法发挥作用,患者必须具有匹配的HLA类型。
TCR-T细胞疗法的优势
TCR-T和CAR-T细胞疗法均由基因工程T细胞组成,经过修饰以表达针对肿瘤抗原的受体。CAR-T细胞疗法是血液癌症领域的一项重大突破,然而,CAR-T细胞在实体瘤中的临床疗效要低得多,存在多种障碍,包括可用抗原的稀缺、肿瘤异质性或肿瘤免疫抑制。相比之下,TCR-T细胞疗法是一种具有多种优势的替代方案。
1.TCR-T细胞治疗的靶向抗原库比CAR-T细胞大。CAR-T细胞只能靶向细胞表面抗原。但人类蛋白质组中近90%的蛋白质仅存在于细胞内区域,CAR根本无法触及。相比之下,内源性TCR凭借其结合域的复杂结构,既能识别细胞内蛋白也能识别膜结合蛋白。
2.TCR-T细胞诱导激活所需的表位密度低于经典CAR-T细胞。
3.TCR-T细胞的高亲和力也可能提高其疗效,与CAR相比,TCR对其靶标的亲和力较低,可能使每个TCR-T细胞能够“扫描”并消除几个呈递抗原的肿瘤细胞。
约翰森绝处逢生:匹配顶尖临床试验
约翰森的故事开始于一次滑雪之旅后,当时31岁的约翰森开始感到惊人的强烈疲劳。约翰森本来以为是COVID引起,但检查后,医生在约翰森的胃里发现了一个肿瘤,初步怀疑是胃癌,于是打算经过手术将他的胃完全切除。然而,随后的活检显示,肿瘤并不是最初认为的胃癌,而是滑膜肉瘤,这是一种非常罕见的癌症,在胃中发现的情况更为罕见。

于是约翰森又再次接受了化疗,在此期间他胃破裂。经过漫长的康复,随后的手术切除了剩余的肿瘤,在这之后的两年时间里,他的生活恢复了相对正常。
但遗憾的是,在手术后两年的检查中,医生在他的骨盆中发现了另一个肿瘤,测试显示它再次是滑膜肉瘤。不过幸运的是,约翰森处于接受尖端免疫疗法治疗的理想地点。那里的Albiruni Abdul Razak博士正是一项专门针对滑膜肉瘤测试TCR-T细胞产品(afami-cel)疗效的SPEARHEAD临床试验的研究员,而约翰森非常幸运的符合试验所需的条件,这使他成为了接受afami-cel的理想人选。
Afami-cel:FDA批准的首款滑膜肉瘤TCR-T疗法
afami-cel是美国食品药品监督管理局(FDA)于2024年8月2日批准的一款治疗滑膜肉瘤的TCR-T细胞疗法。而该批准便基于SPEARHEAD临床试验,该试验共纳入44名转移性滑膜肉瘤患者,而约翰森便是其中一员。
约翰森肿瘤缩小65%的奇迹
在约翰森完成afami-cel输注后,他人生的下一个篇章已经开始。约翰森的生活在接受TCR-T治疗后迅速恢复正常,细胞输注一个月后,即2024年12月,约翰森的肿瘤减少了15%。临近afami-cel治疗一周年时,他的肿瘤已缩小65%。
约翰森的治疗经历让他迫切的想分享他的故事。他既经历过创新治疗手段-TCR-T细胞疗法,也经历过手术、化疗和放疗等传统治疗,因此更能深刻体会这些疗法之间在治疗过程和效果上的天壤之别。他遇到了很多没有幸运地接受TCR-T细胞疗法的患者,他想让更多像他一样的癌症患者有机会接触这些拯救生命的创新治疗。
约翰森的故事不仅是一个医学奇迹,更是一个强有力的号召,为无数仍在困惑是否接受前沿治疗的患者点亮了一盏希望的明灯。
TCR-T疗法的局限性
值得注意的是,尽管TCR-T细胞疗法的确展示出有希望的效果,但TCR-T细胞疗法仍面临一些局限性。譬如价格昂贵,TCR-T细胞疗法通常涉及复杂的生物技术和个体化治疗方案,使得治疗非常昂贵,对许多患者来说是一个巨大的经济负担。并且虽然细胞中存在着大量可供TCR结合的潜在肽段,但这里存在一个关键限制:TCR要发挥作用,不仅需要特异性靶标,还要求该靶标必须与相容的HLA结合。在人类体系中,HLA类型类似于血型系统,但其多样性远超仅有四种类型的血型-目前已知存在数千种HLA分子,且每个人都拥有独一无二的HLA组合。
HLA 基因座实际上是我们拥有的最多样化的遗传基因座,HLA位点中的不同基因决定了复合物将装载并呈递哪些肽段。这种极致的多样性在疫情期间展现出巨大优势-至少能确保部分人群可有效捕获病原体肽段并产生足够免疫应答。但若要设计TCR,就意味着需要为每位患者量身定制不同的TCR方案。
结语
长期以来,细胞疗法在血液癌中取得巨大成功,但对占癌症90%以上的实体瘤却困难重重。TCR-T疗法的突破在于其能突破细胞表面,探测癌细胞内部更丰富的靶点,为攻克滑膜肉瘤、肺癌、肝癌、胃癌等众多实体瘤带来了曙光。尽管TCR-T细胞疗法制作复杂,价格昂贵,但它的出现无疑为实体瘤患者带来了新的选择与希望。随着临床试验的不断开展以及细胞技术的进步下,TCR-T细胞疗法将在更广泛的癌症类型中的应用,在癌症治疗中发挥更重要的作用。