背景:Upadacitinib (UPA)是一种选择性和可逆的Janus激酶抑制剂,已被证明在45 mg的剂量下(QD)作为8周诱导治疗中重度溃疡性结肠炎(UC)是安全有效的。该分析评估了在8周诱导后未达到临床反应的UC患者在延长诱导(45 mg QD,持续16周)后使用UPA维持(15或30 mg QD)治疗的结果。

方法:在U-ACHIEVE诱导(NCT02819635)或U-ACCOMPLISH (NCT03653026)研究中,中重度UC患者在接受UPA 45mg QD诱导治疗8周后未能达到临床缓解(适应梅奥评分较基线下降≥2分和≥30%,直肠出血评分[RBS]或绝对RBS≤1分)。在8周的开放标签延长期中继续接受UPA 45 mg QD。在开放标签延长期结束时,应答者进入U-ACHIEVE维持研究,并按1:1随机分配到UPA 15 mg或30 mg QD,持续52周。诱导研究的疗效终点在第16周评估,维持研究的疗效终点在第52周评估。
结果:总共有125名患者在8周诱导治疗后未能达到临床反应,他们接受了45 mg的开放标签UPA治疗,持续8周。在这些患者中,48.3%在第16周达到临床缓解,并在U-ACHIEVE维持中重新随机分配到UPA 15或30 mg。在进入维持研究的16周应答者中,在第52周分别实现临床缓解、维持临床反应和内镜下改善的比例分别为33.3%对19.0%、66.7%对35.7%,接受UPA 30 mg QD和UPA 15 mg QD作为维持治疗的患者分别为37.5%和23.8%(表1)。在两个维持治疗组中,特别关注的不良事件很少被报道(表2)。
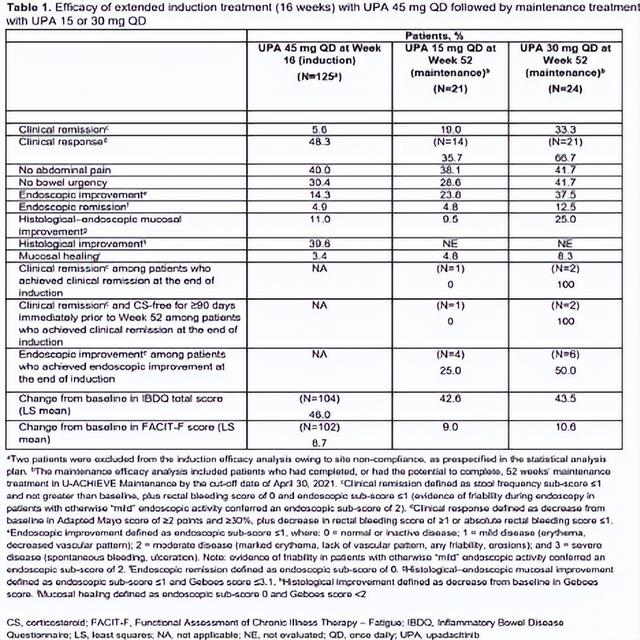
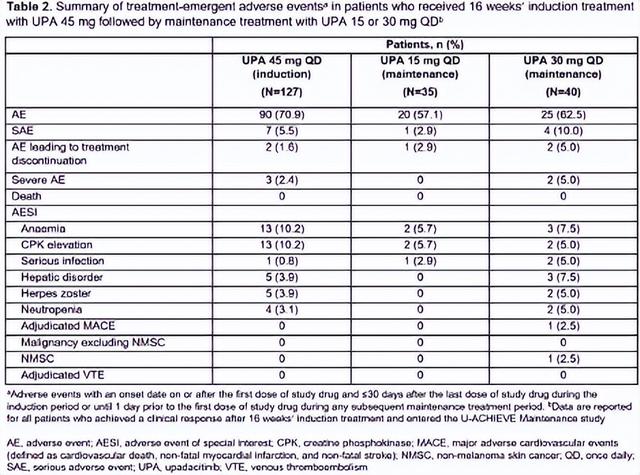
结论:在本分析中,延长16周的诱导治疗对几乎一半的UC患者是有益的,这些患者在用45 mg UPA诱导8周后未能达到临床反应。在这些延迟应答者中,维持治疗的益处得到了进一步证明,UPA 30mg比UPA 15mg QD提供更大的益处。