说明:本文华算科技系统梳理了吸附的定义与核心机理,分门别类阐明物理吸附:范德华力吸附、氢键吸附、反馈π键吸附;化学吸附:氧化还原吸附、酸碱吸附、配位吸附、共价吸附;及离子交换吸附的作用机制、特征公式与典型案例。
一、什么是吸附?
吸附是指物质在界面上自动聚集,使界面浓度高于内部浓度的现象,其核心是 “界面聚集”。
吸附的热力学本质在于吸附剂表面存在不饱和键如固体表面原子的未配对电子,吸附质的聚集可填补这些不饱和键,降低体系总能量,达到稳定状态。
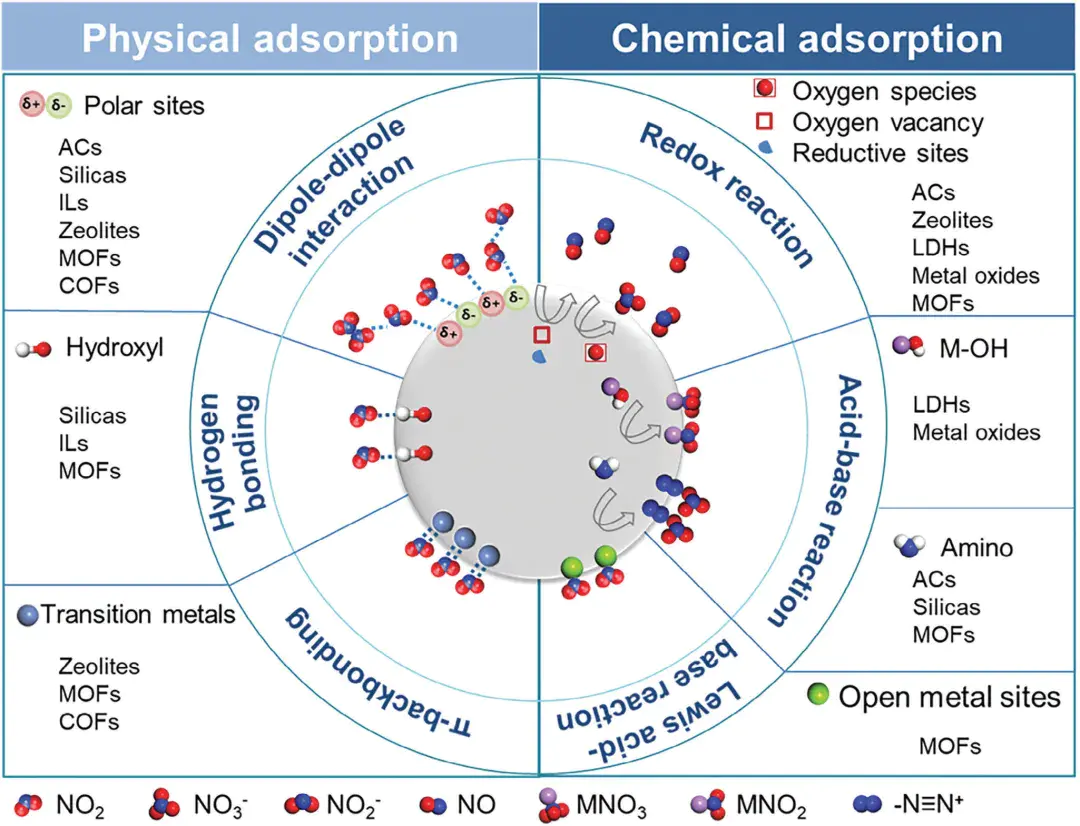
NO2吸附机制示意图。10.1002/adma.202401623
二、核心吸附机理
吸附机理主要依据作用力类型分为三类,不同机理的本质和特点差异显著。
物理吸附:弱作用力主导,无化学键形成
物理吸附是最普遍的吸附类型,依赖分子间弱相互作用,可逆性强、选择性差,核心子类包括 3 种:范德华力吸附、氢键吸附、反馈π键吸附。
1. 范德华力吸附(最基础的物理吸附)
作用力本质:分子间临时偶极产生的弱静电作用,如色散力、诱导力、偶极-偶极相互作用力,无电子转移;
核心特征:吸附质分子结构不变,低温吸附、升温或减压可脱附,脱附温度
典型案例:
活性炭微孔对 NO₂的初步吸附:NO₂分子(极性分子)通过偶极-偶极相互作用力吸附在活性炭的石墨层表面,TPD 显示
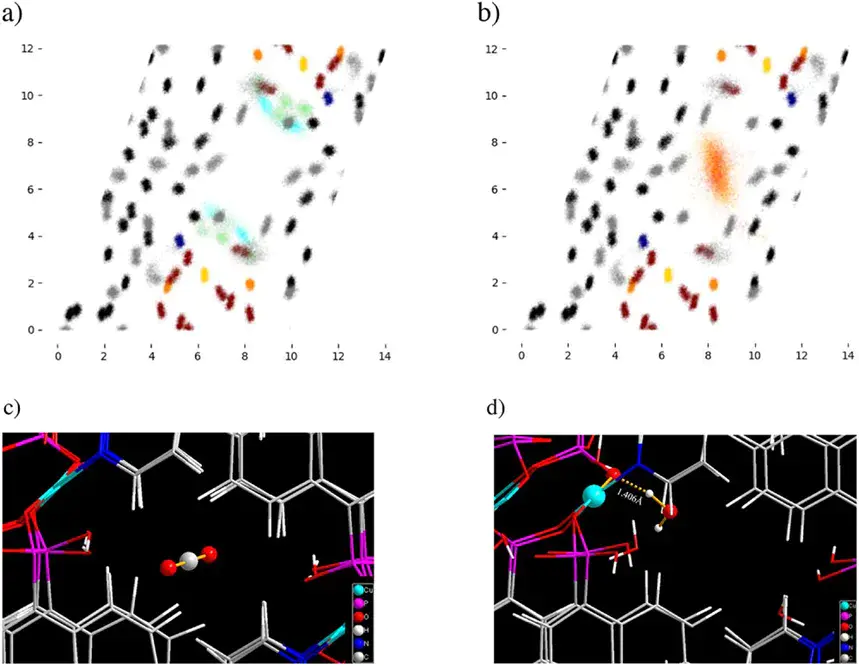
上图对TUB41(一种混合连接体MOF)进行了分子动力学模拟,揭示了TUB41内H2O和CO2的不同吸附机制。10.1002/anie.202513788
2. 氢键吸附(增强型物理吸附)
作用力本质:吸附剂表面的含氢极性基团,如 – OH、-NH₂,与吸附质的电负性原子如NO₂的O、H₂O的O形成强于范德华力的氢键;
核心特征:选择性略高于范德华力,可逆,脱附温度 100-200℃;
典型案例:MFM-300 (Al) 吸附 NO₂:MOF 孔道内的 HO-Al 基团(Hδ+)与 NO₂的 Oδ- 形成氢键,1 bar 下容量达 14.1 mmol/g,5 次循环无衰减。
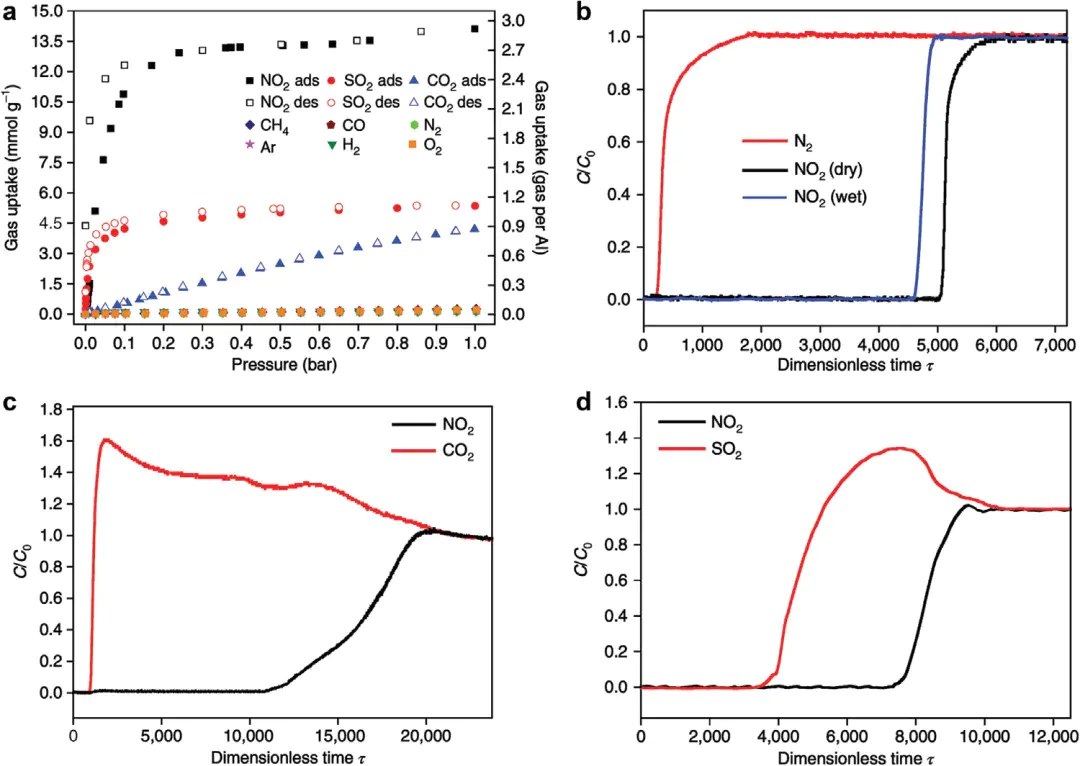
10.1002/adma.202401623
3. 反馈π键吸附(特殊物理吸附,近化学吸附强度)
作用力本质:吸附剂的过渡金属 d 轨道与吸附质的π空轨道发生电子转移,形成中等强度的 π 键;
核心特征:选择性强,可逆性中等,脱附温度 200-300℃,吸附质分子结构略变;
典型案例:Co²⁺交换 CHA 沸石吸附 NO₂:Co²⁺的 3d 电子向 NO₂的 π* 轨道转移,DRIFTS 显示 N-O 键振动峰红移,Si/Al=2 时容量达 4.65 mmol/g。
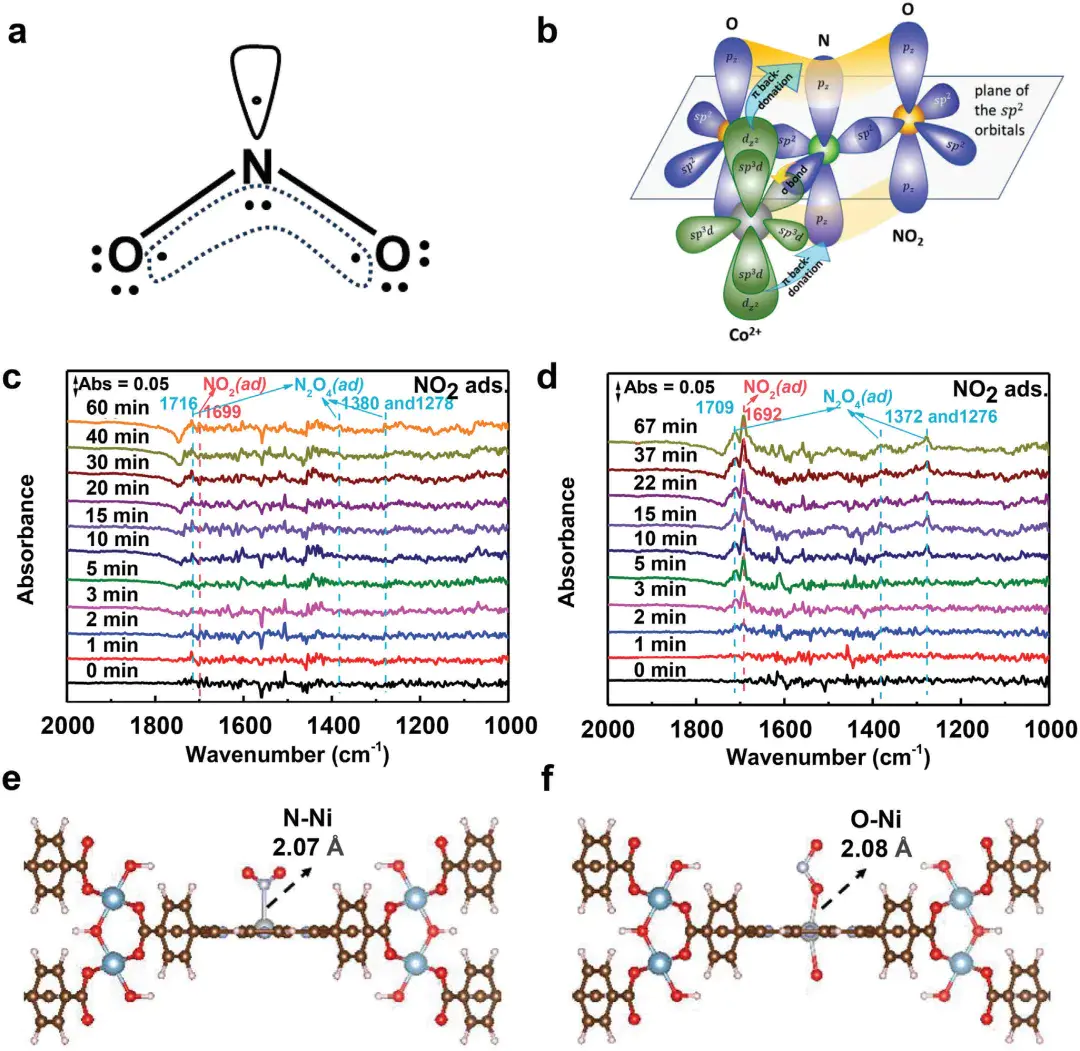
10.1002/adma.202401623
化学吸附:强作用力主导,有化学键形成 / 电子转移
化学吸附依赖原子间的电子共享或转移,形成化学键(离子键、共价键),不可逆性强、选择性高,核心子类包括 4 种:氧化还原吸附、酸碱吸附、配位吸附、共价吸附。
1.氧化还原吸附
作用力本质:吸附剂的可变价活性位点,如 Mn³⁺/Mn²⁺、Fe³⁺/Fe²⁺与吸附质发生电子转移,形成稳定化学键;
核心特征:吸附质发生化学转化,如 NO₂→NO₃⁻、Cr (VI)→Cr (III),不可逆;
典型案例:活性炭还原 NO₂:AC 的活性碳位点(-C*)被氧化为 C (O),NO₂被还原为 NO,反应式:-C* + NO₂ → C (O) + NO。
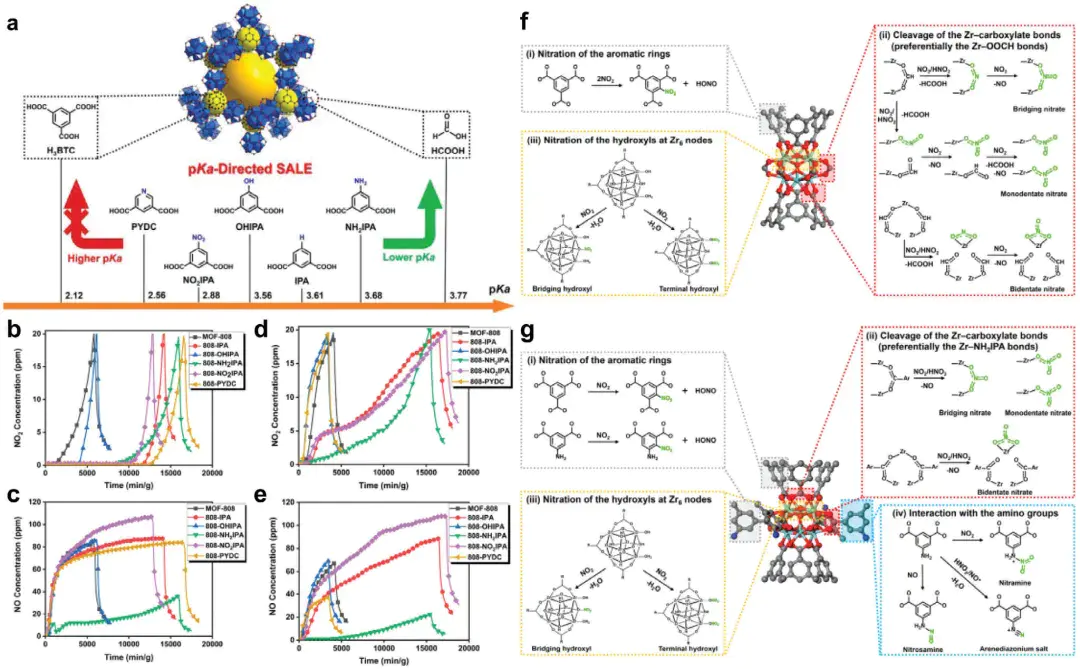
10.1002/adma.202401623
2. 酸碱吸附(Lewis/Brønsted 酸碱作用)
作用力本质:吸附剂的酸性/碱性位点与吸附质的碱性/酸性基团发生质子转移或电子对共享,即Lewis 酸(如金属离子)接受电子对,Lewis 碱(如 – OH、-NH₂)提供电子对;
核心特征:选择性极强,中等不可逆,150-300℃再生;
典型案例:LDHs 吸附 NO₂:LDHs 的 M-OH 碱性位(提供 OH⁻)与 NO₂(酸性分子)发生酸碱反应,生成 M-NO₂和 M-NO₃。
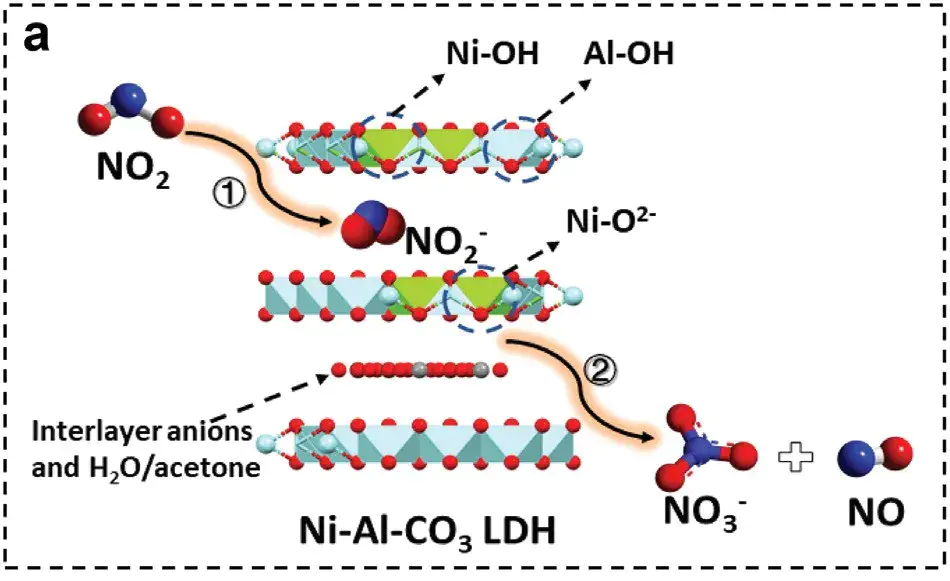
10.1002/adma.202401623
3. 配位吸附(Lewis 配位作用)
作用力本质:吸附剂的开放金属位点如 MOF 中的 Cu²⁺、沸石中的 Na⁺作为 Lewis 酸,接受吸附质的孤对电子形成配位键;
核心特征:吸附质无明显化学转化仅配位结合,可逆性中等,需 200-350℃再生,选择性高;
典型案例:Cu/UiO-66 吸附 NO₂:原子分散的 Cu⁺位点与 NO₂配位,容量从 2.02 mmol/g 提升至 3.96 mmol/g。
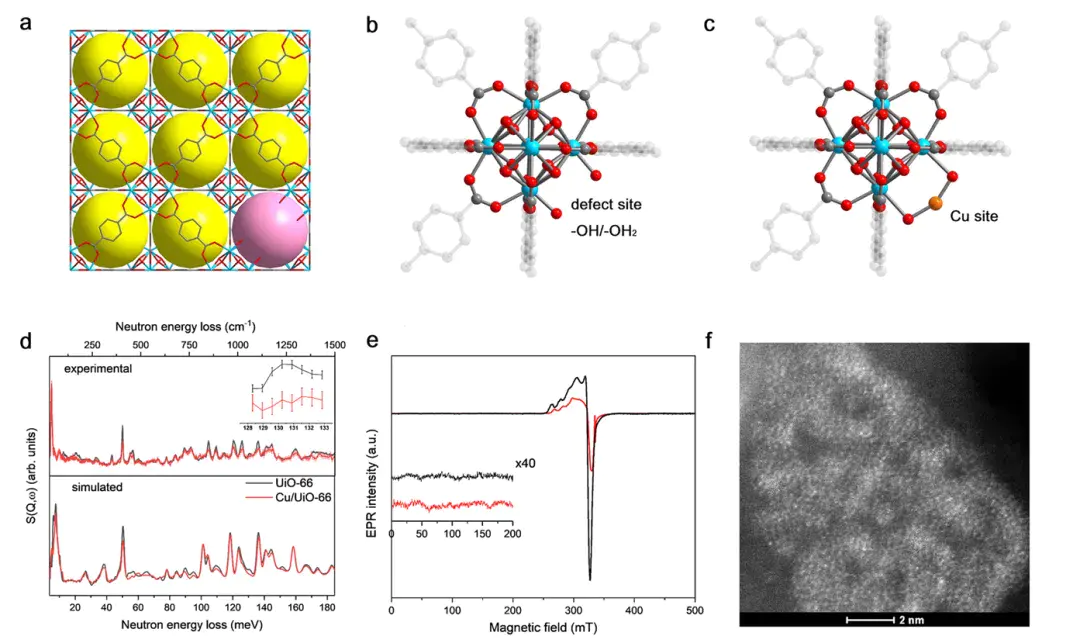
10.1021/jacs.1c03036
4. 共价吸附(强共价键结合)
作用力本质:吸附质与吸附剂表面发生共价键形成反应,如羟基与硅烷偶联剂的缩合、碳碳键形成等,作用力最强;
核心特征:完全不可逆,极少用于可再生吸附,多用于永久性固定;
典型案例:金属有机框架(MOF)的配体交联:部分 MOF 通过配体共价交联固定 NO₂,但因不可逆性,论文中未作为主要吸附机理。
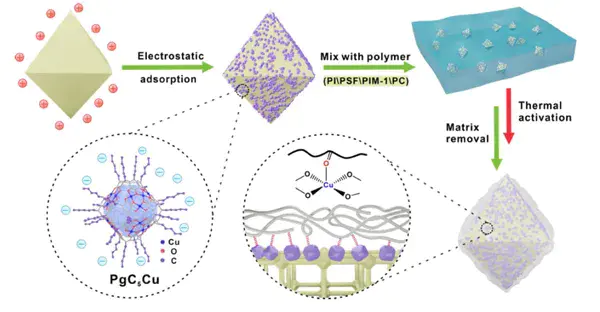
MONC介导的MOF表面改性聚合物的示意图。10.1002/ange.202104487
离子交换吸附:中等作用力,基于电荷平衡
离子交换吸附是特殊的化学吸附,仅发生在带电吸附剂与电解质溶液 / 离子型气体之间。
离子交换吸附
作用力本质:吸附剂表面的可交换离子,如沸石的 Na⁺、离子交换树脂的 H⁺/Cl⁻,与吸附质的异性离子发生等量交换,基于静电引力和电荷平衡;
核心特征:交换比固定(如 1 个 Ca²⁺交换 2 个 Na⁺),可逆,选择性由离子电荷 / 半径决定,电荷越高、半径越小,交换能力越强;
典型案例:MFM-305-CH₃吸附 NO₂:MOF 孔道内的 Cl⁻(平衡骨架正电荷)与 NO₂反应生成 NOCl 和 NO₃⁻,再生时用 NaCl 溶液置换 NO₃⁻,其本质正是离子交换辅助化学吸附。
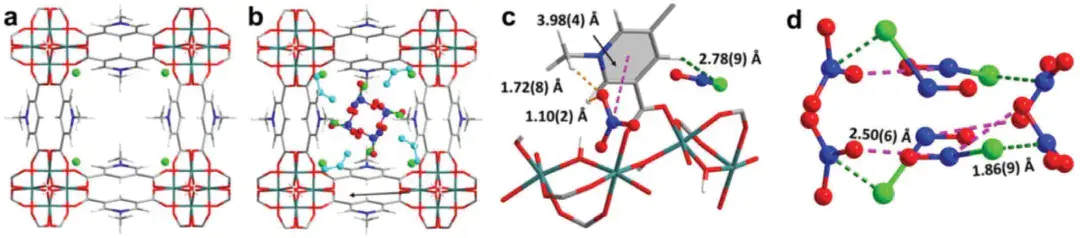
10.1002/adma.202401623
三、吸附机理的关键公式
吸附原理的量化与应用,需通过公式描述吸附平衡、反应过程,以下为核心公式及解析。
物理吸附
物理吸附无化学键形成,核心是 “吸附质 – 吸附剂” 的弱作用平衡,常用吸附等温式描述。
(1)Langmuir 吸附等温式(单分子层吸附)
适用于吸附剂表面活性位点均匀、无吸附质分子间相互作用的场景,如微孔材料对气体的单层吸附:
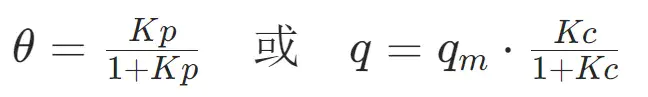
θ:吸附位点覆盖度(0≤θ≤1);
q:实际吸附量(单位:mg/g、mmol/g);
qm:饱和吸附量(单层覆盖时的最大吸附量,反映吸附位点总数);
K:吸附平衡常数(与作用力强度正相关,K越大,吸附能力越强);
p:气体吸附质分压(单位:bar、kPa);
c:液体吸附质浓度(单位:mg/L、mmol/L)。
典型案例:分子筛吸附空气中的水分,符合 Langmuir 等温式 —— 低湿度时吸附量随湿度线性增加,高湿度时逐渐达到饱和。
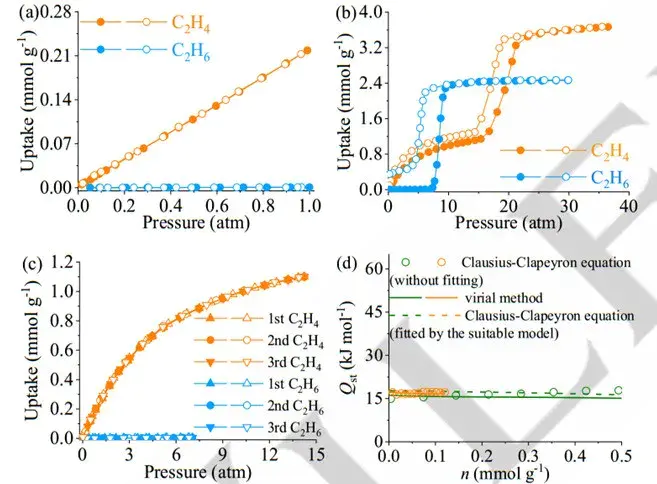
H4H6总结:吸附过程的机理涉及多种作用的协同效应,具体的吸附机理取决于吸附剂和吸附质的性质、温度、压力等条件。对吸附机理的研究对于理解吸附过程、优化吸附剂设计以及应用吸附技术具有重要意义。