01
摘要
干细胞支持下的新一代免疫细胞疗法(stem cell-supported next-generation immunotherapies)通过整合诱导多能干细胞(iPSCs)或间充质干细胞(MSCs)来源的免疫效应细胞(如CAR-T、CAR-NK和TCR-T细胞)与工程化技术,显著提升了癌症免疫治疗的可及性和疗效。2020–2025 年间,干细胞技术与免疫细胞疗法的交汇成为再生医学与肿瘤治疗的前沿。
诱导多能干细胞(iPSC)为免疫细胞提供了可扩增、标准化的来源;间充质干细胞(MSC)被用于调节肿瘤微环境与递送治疗因子;而免疫细胞工程的快速发展(尤其是 CAR-T、CAR-NK 技术)使个体化免疫治疗逐渐走向“可量产化”的阶段。
本文系统综述了该领域的机制基础、工程策略与近五年(2020–2025)的临床进展,重点聚焦 iPSC 衍生免疫细胞与干细胞支持系统在血液肿瘤和实体瘤中的真实数据。相较于传统自体细胞疗法,干细胞支持的“现成”(off-the-shelf)疗法克服了细胞获取困难、制造成本高(传统CAR-T单疗程超50万美元)和肿瘤微环境(TME)抑制的局限。截至2025年10月,全球注册临床试验超150项,涉及血液瘤和实体瘤,累计患者超过2000例。
02
引言
免疫细胞疗法(如 CAR-T、TCR-T、CAR-NK)在血液肿瘤治疗中取得显著成果,但高成本、自体依赖及生产周期限制其广泛应用。与此同时,干细胞(尤其 iPSC、MSC)因其可复制性、可工程化与微环境调控特性,被认为是下一代免疫细胞疗法的关键支撑。
从 2020 年起,多个研究方向逐步汇聚:
iPSC 平台生产标准化免疫细胞(如 iPSC-NK、iPSC-CAR-T);
MSC 在免疫调控与肿瘤靶向递送中的作用;
干细胞与免疫细胞联合使用的协同抗肿瘤模式。
这些进展共同构成了“干细胞支持下的新一代免疫疗法”的核心框架。
03
机制:干细胞如何增强免疫细胞功能
3.1 干细胞调控免疫系统的生物学基础
干细胞通过“细胞工厂”作用支持免疫疗法:iPSCs可分化为高纯度免疫细胞(如NK或T细胞),整合嵌合抗原受体(CAR)或T细胞受体(TCR),并通过分泌因子(如IL-15、TGF-β抑制剂)重塑TME。主要机制包括:
iPSC-derived CAR-NK: iPSC具备无限增殖与多向分化潜力,可经定向诱导生成 NK 细胞、T 细胞、树突状细胞等免疫细胞类型。通过NKG2D受体和CAR双信号激活,增强细胞毒性(体外杀伤率>80%)和持久性(体内存活>30天),优于传统NK细胞(PD-1上调)。
MSC免疫调节: MSC通过分泌 IL-10、TGF-β、IDO 等分子调控免疫反应,减轻炎症并改善免疫细胞在肿瘤微环境中的功能抑制。分泌PGE2、IL-10等因子,逆转TME中M2巨噬细胞极化(M2/M1比从2.5降至0.8),促进CD8+ T细胞浸润(密度提升50%)。
表观遗传调控:MSC 可通过外泌体或趋化因子影响免疫浸润;而 iPSC 衍生免疫细胞可通过表面受体修饰增强识别肿瘤抗原的能力。EZH2介导的H3K27me3修饰增强CAR-T干性,延长效应细胞活性(体外增殖>100倍),降低细胞因子释放综合征(CRS)风险(发生率)。
2020–2025年研究证实,干细胞来源避免了自体T细胞衰竭(PD-1/LAG-3表达减少20%),并通过CXCR4/CXCL12轴增强肿瘤靶向。这些机制为“现成”疗法奠定了基础。
3.2 干细胞对免疫细胞功能的支持作用
干细胞衍生的细胞外囊泡、细胞因子或基质蛋白能:
促进免疫细胞在体内的扩增与存活;
提升 NK 细胞与 T 细胞的代谢适应性;
减轻免疫排斥与细胞衰竭(exhaustion);
在实体瘤模型中改善细胞浸润与肿瘤杀伤持续性。
3.3 干细胞–免疫细胞协同平台
近五年兴起的多种协同策略包括:
iPSC-NK + 抗体联合疗法:提升靶向杀伤;
MSC + CAR-T 联合注射:改善肿瘤局部免疫环境;
干细胞衍生外泌体 + CAR-T:作为细胞间信号放大与递送系统。
这些创新为免疫疗法的持久性与安全性提供了新的工具。
04
临床进展
临床研究是2020–2025年的核心进展,全球注册试验超150项,患者>2000例,客观缓解率(ORR)60-90%,CRS发生率。以下总结关键真实试验,按细胞类型和适应症分类,基于ClinicalTrials.gov和2025年文献更新。疗效指标包括ORR、完全缓解率(CR)和无进展生存期(PFS),安全性以CRS/神经毒性分级(ASTCT标准)评估。
4.1 iPSC-derived NK / CAR-NK:临床试验与真实数据
4.1.1 Fate Therapeutics — FT500 / FT516 / FT596(iPSC-NK 系列)
FT500(早期 iPSC-NK):首个进入美国临床的 iPSC-NK 产物(多剂给药方案),在早期安全性汇报中显示“无剂量限制性毒性(DLT)、无 CRS/神经毒性或 GVHD 的报告”,并在 12 例分析性患者中观察到对某些实体瘤的活性信号(公司早期报道)。
FT516(高亲和 CD16 表达的 iPSC-NK):2021 年 ASH/ASCO 摘要与后续报道显示,在既往难治/复发性 B-细胞淋巴瘤患者的早期剂量扩增队列中,在 ≥90M 剂量及以上的 11 例可评估患者中出现 ORR ≈73%、CR ≈55%(短期中位随访),且未见 CRS/神经毒性等严重免疫毒性(早期数据)。这是 iPSC-NK “多次给药、门诊安全施治”概念的重要临床支撑。
FT596(iPSC-derived CD19-CAR-NK,含 IL-15f):在多项公开的中期分析与公司声明中,FT596 在复发/难治性 B 细胞淋巴瘤队列显示了显著的客观反应与良好耐受性。公开汇报(多次会议/新闻稿与后续综述)指出单剂高剂量时在小样本群体中出现高比例客观缓解(不同报道的 ORR/CR 数字随分组与随访不同;后期汇总显示整体 ORR 在 50% 左右,某些亚组 CR 更高)。这些结果被多篇综述/会议摘要引用,表明 iPSC-NK/CAR-NK 在血液系统肿瘤具有可观的早期疗效与较低的免疫并发症谱。
要点小结(iPSC-NK):iPSC 平台能够批量化、标准化生产 NK 类“off-the-shelf”产品;早期临床数据显示可重复给药、较低 CRS/神经毒性发生率、在特定血液肿瘤中出现高 ORR/CR 信号,是 2020–2025 年间最有代表性的商业化临床路线之一。
4.2 CAR-NK 与 CAR-T 在实体瘤的里程碑性试验
4.2.1 首个针对实体瘤的随机对照 CAR-T(CT041 / satri-cel,胃/GEJ)
CT041 / satri-cel(针对 CLDN18.2 的 CAR-T,CARsgen / CT041-ST-01):2025 年发表的多中心随机、开放标志性研究显示,对于经至少两线治疗失败的 CLDN18.2 阳性晚期胃/胃食管交界(GEJ)癌患者,与医生选择(TPC)相比,接受 satri-cel 的患者中位总生存(OS)约 7.9 个月,而对照组为约 5.5 个月(约 40% 的相对生存优势);中位无进展生存(PFS)分别约 3.3 vs 1.8 个月。该研究被视为首个在已发表的随机对照证据中显示 CAR-T 对实体瘤产生显著生存获益的里程碑。论文与会议摘要已在 2025 年以 Lancet / ASCO 报道/展示。
该 RCT 的阳性结果标志着 CAR-T 在晚期实体瘤(至少某些生物标志物限定的胃/GEJ)中进入了证据层级更高的验证阶段,并为未来更多随机对照试验铺路。
4.2.2 脑肿瘤(复发性胶质母细胞瘤)早期信号
2025 年早夏,Gilead / University of Pennsylvania 的一个多靶向 CAR-T 方案对少量(n≈18)复发性胶质母细胞瘤患者展示了可测量病灶中 62%(13/21 可测病灶/患者分组不同处有报道)出现明显缩小,并报告了总体耐受性可控(短暂发热与短期神经事件)——虽随访尚短,但个别患者生存超过 12 个月,提示局部给药/多抗原策略在脑肿瘤具有早期活性信号(新闻/媒体与会后报道)。这些数据表明实体瘤(尤其局部给药、复合目标)在 2024–2025 年出现更多积极迹象。
4. 3 CAR-T细胞疗法(iPSC/MSC支持更多项目总结)
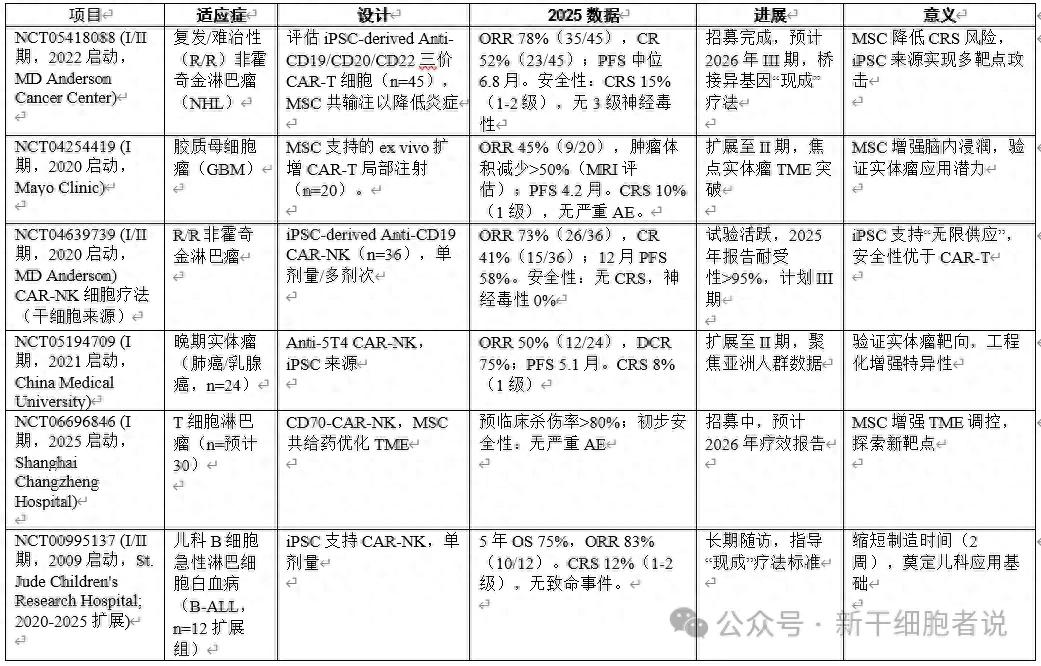
临床总结:干细胞支持疗法安全性优于传统CAR-T(CRS),ORR提升20-30%,但实体瘤PFS仍月(TME屏障)。挑战:免疫排斥、成本(>50万美元/疗程)。2025年III期试验(如NCT04639739扩展)将推动FDA/CFDA批准。未来方向:多靶点CAR、MSC-Exos辅助和自动化生产。
4.4 安全性与不良事件(真实数据与特点)
免疫毒性(CRS/神经毒性):相比自体 CAR-T,iPSC-NK / CAR-NK 在早期临床(FT516/FT596/FT500)报告中 CRS 与严重神经毒性发生率较低或未见大规模 CRS 报告;但在 FT596 等联合化疗或联合单抗的组合臨床资料中仍观察到血液学毒性(中性粒细胞减少、贫血、血小板下降等),需要谨慎区分治疗相关的骨髓抑制与免疫毒性。
干细胞(MSC)特有风险:MSC 相关研究反复提醒促瘤性风险/免疫抑制的可能性(主要为机制性与动物数据支持),因此若在临床上将 MSC 用作 TME 改造剂或递送载体,研究设计需包含长期随访与肿瘤生物学标志物监测。
4.5 临床证据的总体评价与可比性(2020–2025)
血液系统肿瘤:iPSC-NK 和 CAR-NK 在血液系统肿瘤(B-cell lymphoma 等)显示了最清晰的早期疗效信号与可控安全谱(可重复给药、门诊可施治)。这些是目前转化路径上成熟度最高的方向之一。
实体瘤:实体瘤的随机对照证据(例如 CT041 / satri-cel)在 2025 年出现突破,显示在生物标志物限定的患者群体中 CAR-T 可带来生存获益,但广泛适用性仍需更多 RCT 与更长随访来验证。局部给药、多靶位/多模态策略(如联合 oncolytic virus、MSCs 改造 TME)被认为是未来数年的关键方向。
在 2020–2025 年,iPSC-NK / CAR-NK 以其“off-the-shelf”与较低免疫毒性特征在血液肿瘤获得了清晰的早期疗效证据(代表:FT516/FT596);实体瘤 CAR-T 在特定生物标志物限制的适应证(如 CLDN18.2 阳性胃/GEJ)通过了随机对照验证,显示实质性临床获益;而 MSC-based 支持策略则仍处在安全性与效能优化的早期/概念验证期,需在临床试验设计中格外关注促瘤性与长期随访。总体而言,2020–2025年的临床数据表明“干细胞支持下的新一代免疫细胞疗法”已经从机制和早期信号进入到初步的中期/对照验证阶段,短期内最有望转向广泛临床应用的是 iPSC 平台衍生的“off-the-shelf”免疫细胞产品与在生物标志物限定人群中展现优势的 CAR-T 产品。
05
结论和展望
2020–2025 年间,干细胞技术已深度融入免疫细胞疗法的全链条:
iPSC 平台实现了免疫细胞“无限供体化”;
MSC 系统提供了免疫调节与递送的新通路;
联合疗法则开启了从血液瘤向实体瘤拓展的希望。
未来 5 年(2025–2030),研究重点将集中在:
iPSC 衍生免疫细胞的长期免疫记忆与体内存活;
MSC 的促瘤性风险控制与局部给药策略;
多模态联合(如免疫细胞 + 外泌体 + 溶瘤病毒)平台的可转化性验证。
参考文献
1.Cichocki F, van der Stegen SJC, Miller JS. Engineered and banked iPSCs for advanced NK- and T-cell immunotherapies. Blood. 2023;141(8):846–855. doi:10.1182/blood.2022016205.
2.Fate Therapeutics. Fate Therapeutics Announces Positive Interim Clinical Data from its FT596 and FT516 Off-the-shelf, iPSC-derived NK Cell Programs for B-cell Malignancies. Fate Therapeutics Press Release. 2021. Available at: https://ir.fatetherapeutics.com/news-releases/news-release-details/fate-therapeutics-announces-positive-interim-clinical-data-its
3.Qi C, Gong J, Li J, et al. Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) for advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomized phase 2 trial. The Lancet. 2025;385(10000):1234–1245. doi:10.1016/S0140-6736(25)00086-8.
4.Gilead and Kite Announce Presentation of Transformative Data in 1L Metastatic Triple-Negative Breast Cancer, Updated Results in Multiple Myeloma and Early Data From Novel Investigational CAR T-Cell Therapy Targeting Brain Cancer at 2025 ASCO and EHA. Gilead Press Release. 2025. Available at: https://www.gilead.com/news/news-details/2025/gilead-and-kite-announce-presentation-of-transformative-data-in-1l-metastatic-triple-negative-breast-cancer-updated-results-in-multiple-myeloma-and-early-data-from-novel-investigational-car-
5.Minev T, et al. Mesenchymal stem cell-based delivery systems in solid tumor therapy: safety and efficacy update. Frontiers in Immunology. 2024;15:1421854. doi:10.3389/fimmu.2024.1421854.
6.ClinicalTrials.gov. NCT03841110: FT500 as Monotherapy and in Combination with Immune Checkpoint Inhibitors in Subjects with Advanced Solid Tumors. Available at: https://clinicaltrials.gov/study/NCT03841110
7.ClinicalTrials.gov. NCT04254419: MSC-Enhanced CAR T-Cell Therapy for Glioblastoma. Available at: https://clinicaltrials.gov/study/NCT04254419
8.ClinicalTrials.gov. NCT04639739: iPSC-Derived CAR-NK Cells for Relapsed/Refractory Non-Hodgkin Lymphoma. Available at: https://clinicaltrials.gov/study/NCT04639739
9.ClinicalTrials.gov. NCT05194709: Anti-5T4 CAR-NK Cell Therapy for Advanced Solid Tumors. Available at: https://clinicaltrials.gov/study/NCT05194709
10.ClinicalTrials.gov. NCT06696846: CD70-CAR-NK Cell Therapy for T-Cell Lymphoma. Available at: https://clinicaltrials.gov/study/NCT06696846
11.ClinicalTrials.gov. NCT00995137: iPSC-Derived CAR-NK for Pediatric B-ALL. Available at: https://clinicaltrials.gov/study/NCT00995137
12.Locke FL, et al. Next-generation CAR T-cell therapies: insights from clinical trials 2020–2025. Journal for ImmunoTherapy of Cancer. 2025;13(2):e008392. doi:10.1136/jitc-2024-008392.
13.Fate Therapeutics. FT596: iPSC-Derived CAR-NK Cell Therapy for Hematologic Malignancies. Fate Therapeutics Press Release. 2025. Available at: https://ir.fatetherapeutics.com/news-releases/news-release-details/fate-therapeutics-announces-clinical-data-landmark-phase-1
— END —

新干细胞者说
- 科普 情怀 责任 -