
如果还以为肺癌只是“老烟枪”的专利,那这个观念急需刷新了。最新的研究和临床数据揭示了一个更为严峻的事实:在中国,许多从不吸烟的女性,其罹患肺癌的风险,甚至超过了有长期吸烟史的男性。这一反常识的现象,正成为一种独特的“中国式”健康危机,背后隐藏着油烟、基因与环境的复杂纠葛。

图源:CMT
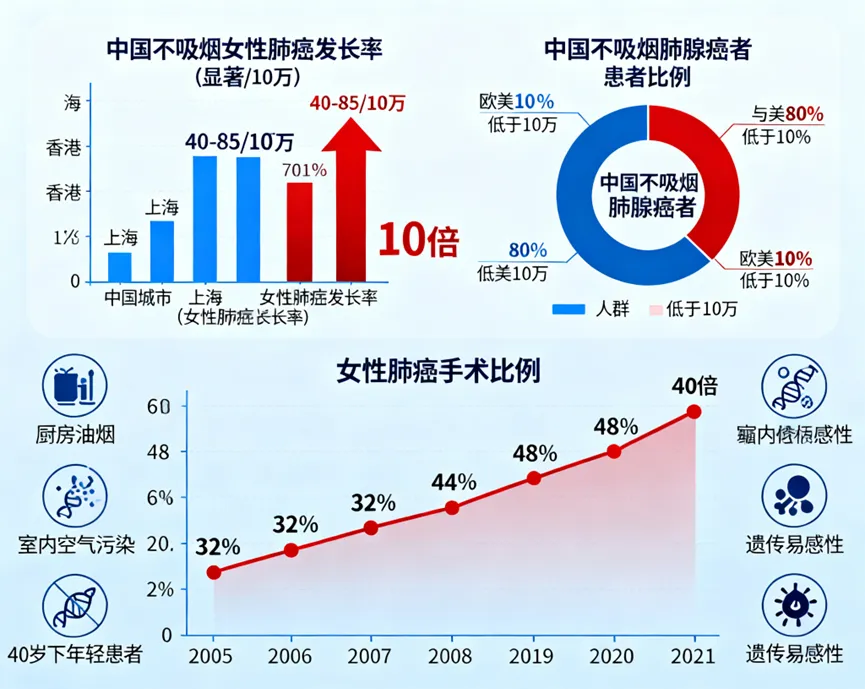
不吸烟女性肺癌发病率显著上升,中国尤为突出近年来,全球肺癌流行病学呈现出一个显著趋势:不吸烟人群的发病率持续上升,其中中国不吸烟女性肺癌的快速增长尤为引人关注。多项研究证实,中国不吸烟女性肺癌发病率显著高于欧美地区,且年轻女性逐渐成为新的高风险群体1。数据显示,上海、香港、天津等城市女性肺癌发病率高达40–85/10万,远高于欧洲和非洲地区的水平(通常低于10/10万),其差距可达10倍以上2。尤为值得注意的是,欧美国家不吸烟肺腺癌患者比例通常低于10%,而中国部分地区这一比例超过80%,凸显出独特的地区性差异3。
这一趋势在临床手术患者中亦得到印证。2005年至2021年间,女性患者在肺癌手术中的比例从32%上升至48%,其中超过70%的患者从不吸烟。更令人担忧的是,40岁以下年轻女性患者数量翻倍,且腺癌占比从60%增至80%以上,提示肺癌的发病机制可能与传统的吸烟关联性减弱,而环境、遗传及激素等因素的影响日益凸显4。
中国不吸烟女性肺癌高发的可能原因包括长期暴露于厨房油烟、室内空气污染、遗传易感性以及激素水平变化等。这一现象不仅挑战了以吸烟为核心的肺癌传统防控策略,也呼吁公共卫生政策需更加关注女性特定风险因素,推动早期筛查和精准预防。未来研究需进一步探索其分子机制,以制定更有效的干预措施。
图源:CMT
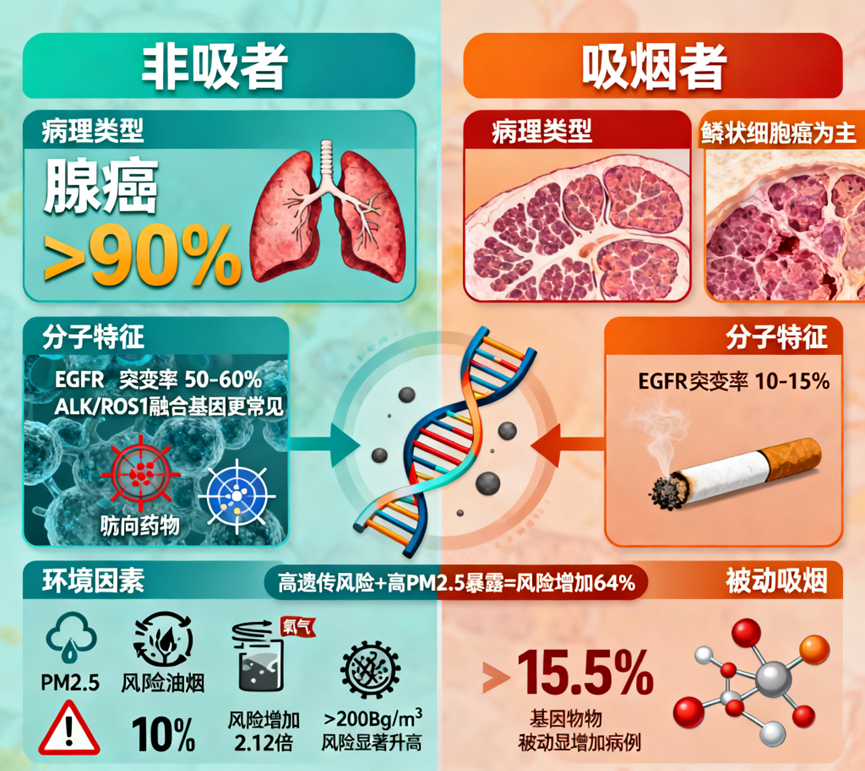
为什么从不吸烟也会得肺癌?肺癌在非吸烟人群中的流行病学特征与吸烟者存在显著差异,其病理类型分布呈现明显特异性。研究表明,非吸烟者肺癌以腺癌为主,占比超过90%,而吸烟者更易罹患鳞状细胞癌。这种差异可能与两种人群的致癌机制不同有关:吸烟相关的肺癌主要与烟草中的多环芳烃等致癌物直接损伤气道黏膜相关,而非吸烟者肺癌则更多与遗传易感性和环境暴露因素相互作用相关4。
分子机制研究进一步揭示,非吸烟者肺腺癌具有独特的驱动基因谱。EGFR突变率在东亚非吸烟人群中高达50-60%,远高于吸烟者的10-15%5。此外,ALK、ROS1等融合基因也在非吸烟者中更为常见。这些分子特征不仅解释了病理类型的差异,也为精准靶向治疗提供了依据6。
环境因素在非吸烟者肺癌发病中起着关键作用。长期暴露于PM2.5等空气污染物可使肺癌风险增加10%以上7。厨房油烟暴露,特别是无通风条件下的高温烹饪,会使女性肺癌风险增加2.12倍8。室内氡气浓度超过200Bq/m³时,肺癌风险显著升高。此外,被动吸烟可解释约15.5%的非吸烟者肺癌病例9。
遗传因素也不容忽视。全基因组关联研究发现,东亚人群特有的基因位点如6p21.33与肺癌风险密切相关。当高遗传风险个体同时暴露于高水平PM2.5时,患病风险可增加64%。这提示基因-环境交互作用在非吸烟者肺癌发生中具有重要意义10。
图源:CMT
除了戒烟,我们还能做什么?肺癌的预防与筛查策略需从个体防护与社会支持两个维度协同推进。在个体层面,主动采取防护措施至关重要。改善厨房通风环境是有效手段之一,建议使用吸力强度不低于18m³/min的侧吸式油烟机,并减少高温爆炒烹饪方式,优先选择蒸煮等低温烹饪方法。对于居住环境,装修超过五年的房屋建议进行年度室内氡气浓度检测,若数值超过100Bq/m³则应安装主动式排氡系统11。
在早期筛查方面,低剂量螺旋CT(LDCT)已成为重要的检测工具。特别值得注意的是,35岁以上具有肺癌家族史、长期暴露于高污染环境或携带高遗传风险评分(PRS)的女性群体,更应将其纳入定期体检项目。筛查发现的肺部结节需通过多学科会诊进行精准评估,避免过度诊断与治疗11。
社会层面需要构建系统化的支持体系。通过加强空气质量治理,特别是对PM2.5等细颗粒物的管控,可显著降低环境风险因素。医疗机构应推动制定针对非吸烟人群的肺癌筛查专家共识,优化筛查策略的敏感性与特异性。同时,积极推广"基因-环境"交互作用风险评估模型的应用,实现从群体防控到个体精准预防的转变。这些措施共同构成了肺癌综合防治网络,为提升全民健康水平提供重要保障11。

图源:CMT
结语综上所述,不吸烟女性肺癌发病率的显著上升,尤其是中国地区呈现的独特流行病学特征,标志着肺癌防治已进入一个需要重新审视与拓展认知的新阶段。这一趋势不仅揭示了环境暴露、遗传易感性与内在激素等因素交织作用的复杂病因网络,也深刻挑战了以吸烟为核心的单一防控范式。未来,唯有通过深化分子机制探索、构建精准风险评估体系,并在公共卫生政策中强化性别与环境视角,才能有效应对这一严峻挑战,为全体人群,尤其是非吸烟女性,筑起更坚实、更个性化的健康防线。
参考文献
1. 高忠嵩, 叶兆祥, 张鹏, 崔效楠, 谢永生, 韩丽珠. 天津地区低剂量CT肺癌基线筛查与随访的初步临床分析[J].中国肿瘤临床, 2017, 44(20): 1034-1039.
2.李为希,周洁,张芬,严玉洁,许慧琳,刘亦男,徐东丽,方红.2002~2012年上海市闵行区肺癌发病及死亡分析[J].中国肿瘤,2016,25(7):514-518
3.涂小娟. 吸烟肺癌与非吸烟肺癌对比研究[D]. 江苏:苏州大学,2018.
4.黄翠翠. 早期肺癌中不吸烟女性肺癌的占比的变化及预后模型的建立[D]. 山东:山东大学,2020.
5.Tseng CH, Chiang CJ, Tseng JS, Yang TY, Hsu KH, Chen KC, Wang CL, Chen CY, Yen SH, Tsai CM, Huang MS, Ho CC, Yu CJ, Tsai YH, Chen JS, Chou TY, Tsai MH, Chen HY, Su KY, Chen JJW, Chen HW, Yu SL, Liu TW, Chang GC. EGFR mutation, smoking, and gender in advanced lung adenocarcinoma. Oncotarget. 2017 Oct 12;8(58):98384-98393.
6.Grosse C, Soltermann A, Rechsteiner M, Grosse A. Oncogenic driver mutations in Swiss never smoker patients with lung adenocarcinoma and correlation with clinicopathologic characteristics and outcome. PLoS One. 2019 Aug 6;14(8):e0220691.
7.王玉婕,冯昊,马山蕊,等.同时性多原发肺腺癌表皮生长因子受体基因突变相关因素分析[J].中华医学杂志,2019,99(29):2297-2301.DOI:10.3760/cma.j.issn.0376-2491.2019.29.010.
8.陈菊香,朱利群,费小东,等. 信迪利单抗联合安罗替尼治疗三线及以上肺腺癌患者的临床疗效[J]. 现代肿瘤医学,2022,30(14):2543-2547. DOI:10.3969/j.issn.1672-4992.2022.14.012.
9.Du Y, Cui X, Sidorenkov G, Groen HJM, Vliegenthart R, Heuvelmans MA, Liu S, Oudkerk M, de Bock GH. Lung cancer occurrence attributable to passive smoking among never smokers in China: a systematic review and meta-analysis. Transl Lung Cancer Res. 2020 Apr;9(2):204-217.
10.Brhane Y, Yang P, Christiani DC, Liu G, McLaughlin JR, Brennan P, Shete S, Field JK, Tardón A, Kohno T, Shiraishi K, Matsuo K, Bossé Y, Amos CI, Hung RJ. Genetic Determinants of Lung Cancer Prognosis in Never Smokers: A Pooled Analysis in the International Lung Cancer Consortium. Cancer Epidemiol Biomarkers Prev. 2020 Oct;29(10):1983-1992. doi: 10.1158/1055-9965.EPI-20-0248. Epub 2020 Jul 22. PMID: 32699080; PMCID: PMC7541720.
11.中国肺癌早诊早治专家组,中国西部肺癌研究协作中心. 中国肺癌低剂量CT筛查指南(2023年版)[J]. 中国肺癌杂志,2023,26(1):1-9.
来源:医学论坛网
编辑:常寂光
审核:梨九
排版:蓝桉
封面图源:CMT