说明:本文指出电催化并非“吸附越强越好”,以Sabatier原理揭示适度吸附才最佳,并给出吸附能定义与量化方法;继而用火山曲线展示活性与吸附能非线性关系,系统归纳缺陷、晶面、尺寸、应变、合金化、掺杂六大调控策略,帮助读者掌握优化催化性能核心思路。
电催化中吸附越强越好吗?
,也是决定整体效率的瓶颈环节。
过强的吸附会导致产物脱附困难,过弱的吸附则无法有效活化反应物。
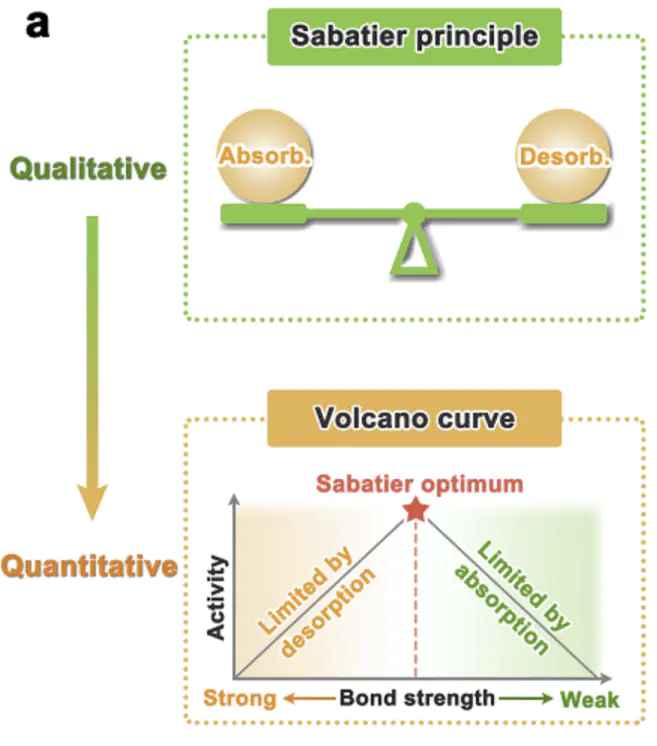
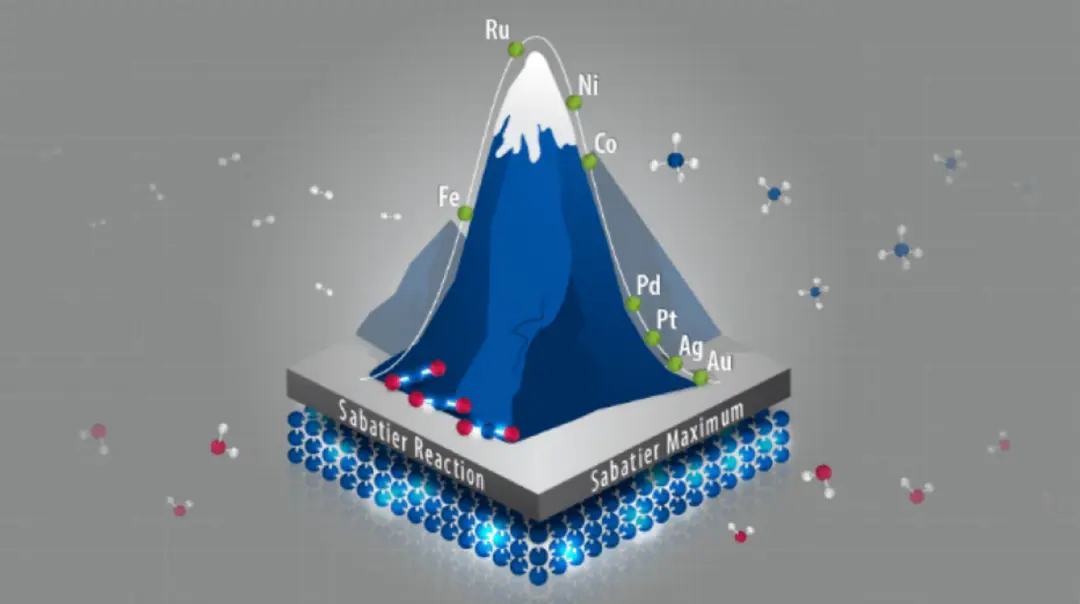
Sabatier为此提供了理论基石:最优催化剂应对中间体具有适度的吸附强度,既能稳定关键中间体降低反应能垒,又能确保产物顺利脱附释放活性位点该原理在电催化中具象化为著名的火山型关系—催化活性与吸附能呈非线性抛物线关系,。
1:多数反应分子(如O₂、N₂、CO₂)本身化学性质稳定,直接进行电化学转化的能垒很高。它们必须,为后续的电子注入和转化创造条件。
)中间体稳定化的关键这些中间体的生成、转化和脱附都高度依赖于其在催化剂表面的吸附强度3:如果产物或某个副产物中间体的吸附过强,它会牢固地。因此,对产物吸附强度的控制同样至关重要。
电催化中的吸附强度本质上是,通常以E)吸附自由能(ΔG)对于电化学反应,由于涉及电荷转移和溶剂化效应,吸附自由能比单纯吸附能更能准确描述实际过程。
吸附强度由多种相互作用力共同决定:
:包括共价键、离子键和金属键,是吸附强度的主要来源。
:带电物种与表面电荷的库仑相互作用,受离子强度显著影响。
:在水相电催化中,非极性分子倾向于吸附在疏水表面。
:分子极化能力越强,越容易被表面吸附。
吸附强度的数学描述
吉布斯吸附自由能(ΔG)其中,为吸附态物种的吉布斯自由能,为洁净表面的自由能,为气相参考物种的自由能。该定义表明,ads。
零点能()、热容和熵变(ΔS)UpHadsΔE通过密度泛函理论()计算获得,是理论预测的核心。
Sabatier最优催化活性出现在那些对反应中间体具有适中吸附强度的催化剂上这一原理的微观机制可理解为:
:如果反应物或中间体在催化剂表面吸附得太弱,它们无法被有效捕获和活化,或者停留时间过短,导致反应速率受限于吸附步骤吸附过强。这会导致活性位点被长时间占据,反应速率受限于脱附步骤,甚至引发催化剂中毒。
DOI: 10.1021/acs.chemrev.1c01003
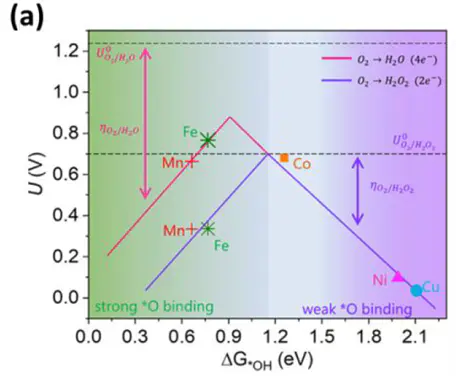
火山曲线的构建与解读
Sabatier。
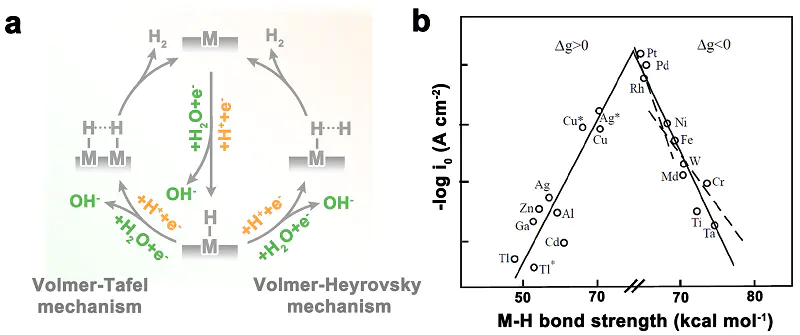
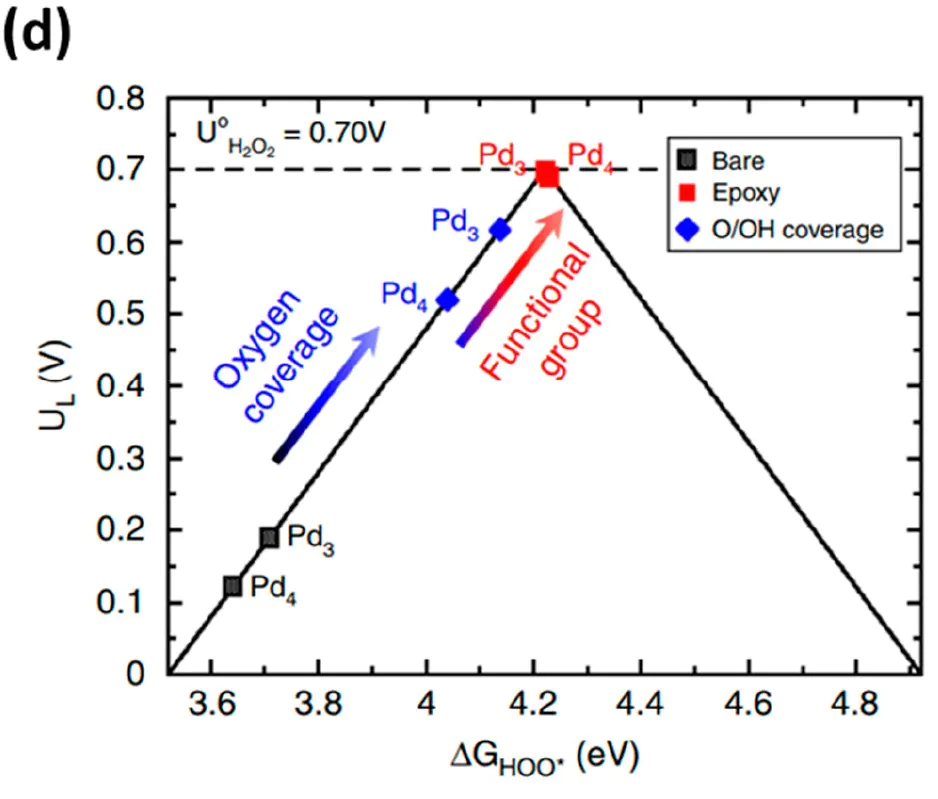
火山左翼(上升支)火山右翼(下降支)火山顶点。这正是原理所追求的黄金中点。
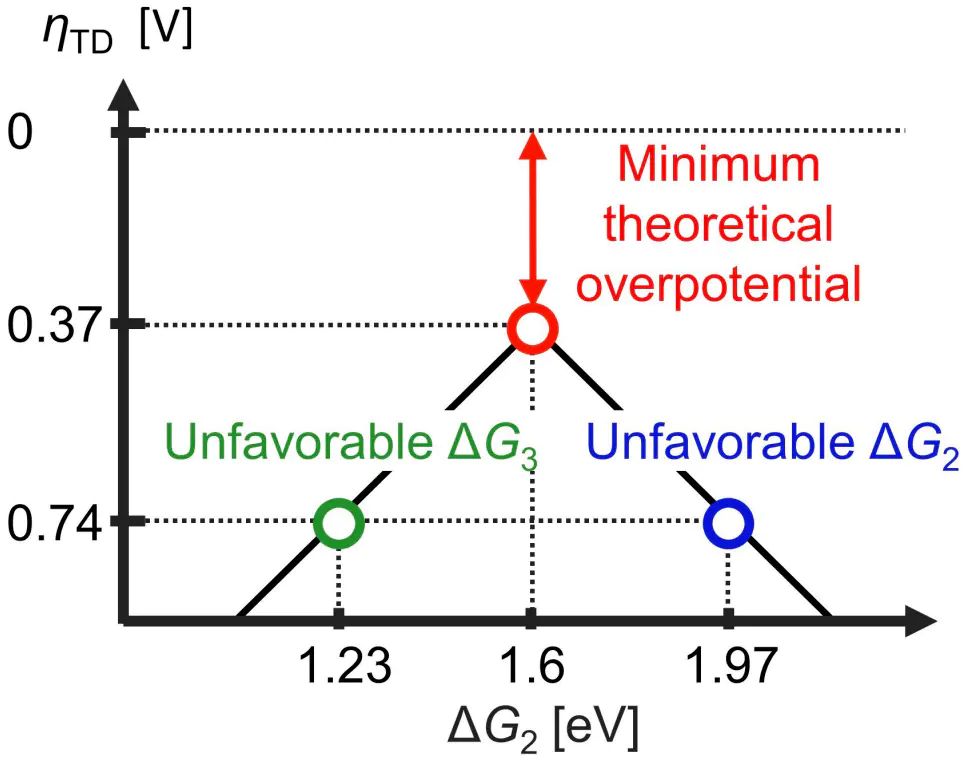
如何调控吸附强度?
缺陷工程
空位、位错、晶界。
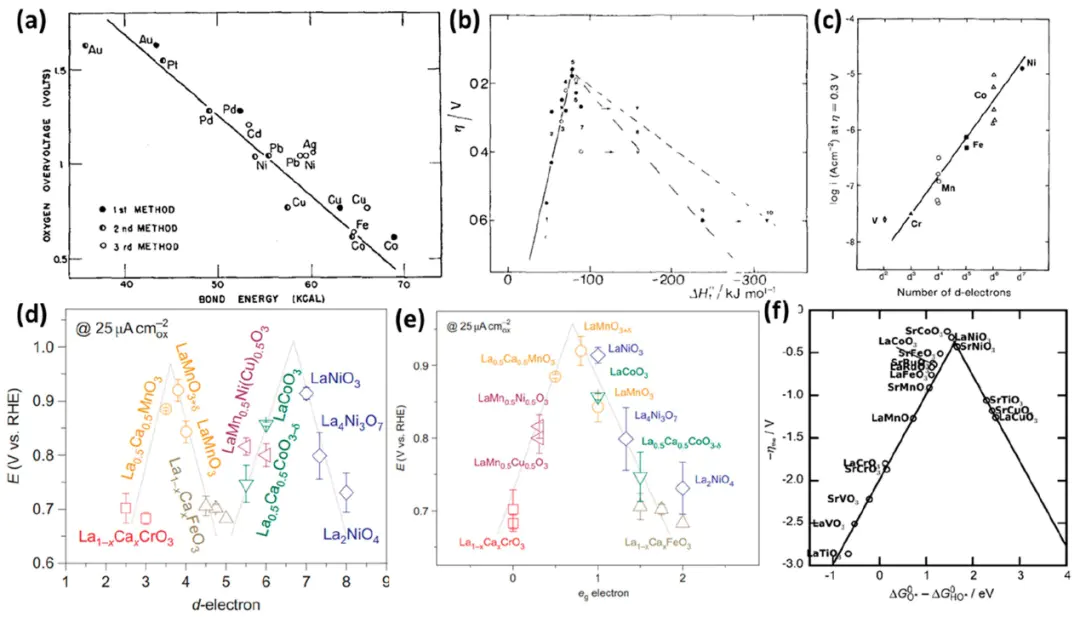
H₂O不同晶面暴露的原子排布和配位环境不同,对同一物种的吸附能力差异巨大。通过合成特定暴露晶面的纳米晶体,可以实现对吸附能的定向调控例如,晶面ORR遵循过氧化物解离路径,Pt(100)遵循氧解离路径,Pt(111)因吸附能更适中表现更优。
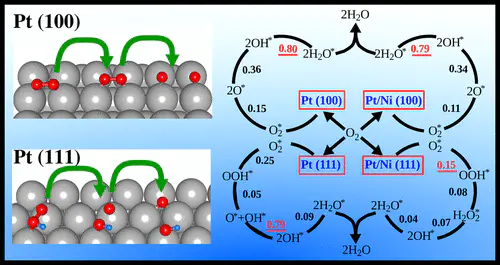
纳米材料。
LaCoO3g80g1.2DOI: 10.1021/acs.chemrev.1c01003
应变工程
d轨道电子态,从而精细调控吸附强度例如,合金中Cu含量增加,压应变增强,d带中心下移,O吸附能提升。
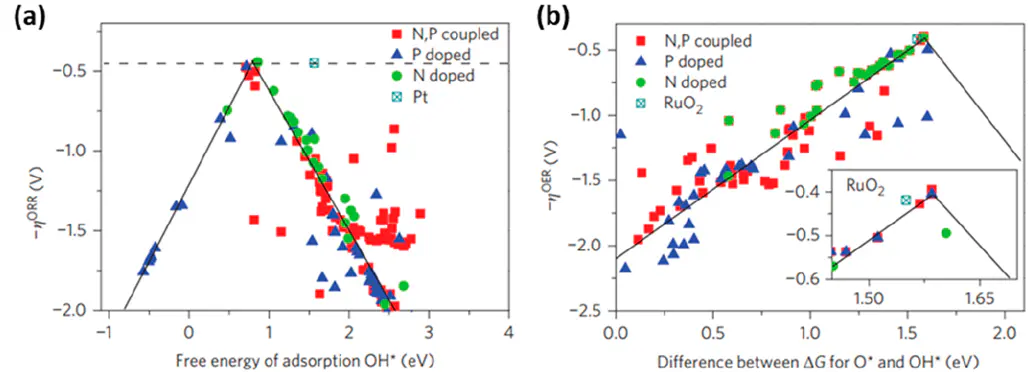
将两种或多种金属形成合金,通过不同金属原子间的(配体效应)和,可以打破单一金属的吸附限制,将吸附能调至更优的范围。
PtHgDOI: 10.1021/acs.chemrev.1c01003
掺杂调控
Fe。例如,共掺杂石墨烯,ORR和OER过电位分别低至0.44V和0.39V,优于商业Pt/C和RuO₂。