系统阐释“”概念,解析活化与浓度极化来源,介绍LSV、Tafel、EIS等实验测定手段及通过找过电位的方法,为评估和优化催化活性提供量化依据。
什么是过电位
电化学,是电化学反应得以产生净电流的必要条件。
η = |U实际0注意:过电位是一个绝对值,仅反映 “差距大小”与反应方向无关。
水分解反应中析氢反应及析氧反应示意图。DOI: 10.1021/acs.chemrev.9b00248
过电位的核心本质
这些阻力主要来自两个方面,对应两种主要的极化类型:
源于电极表面反应本身的速率限制。浓度极化:比如反应物来不及扩散到电极表面,导致电极附近浓度降低,为了维持反应速率,需要更高电位,由此产生浓度过电位。
DOI:10.5772/intechopen.77109
量化过电位的核心方法
原理以缓慢速率(如 5~10 mV/s)扫描电极电位,记录电流密度变化,得到 “电位 – 电流” 曲线;
:优势快速直观,可初步判断催化剂的活性高低。
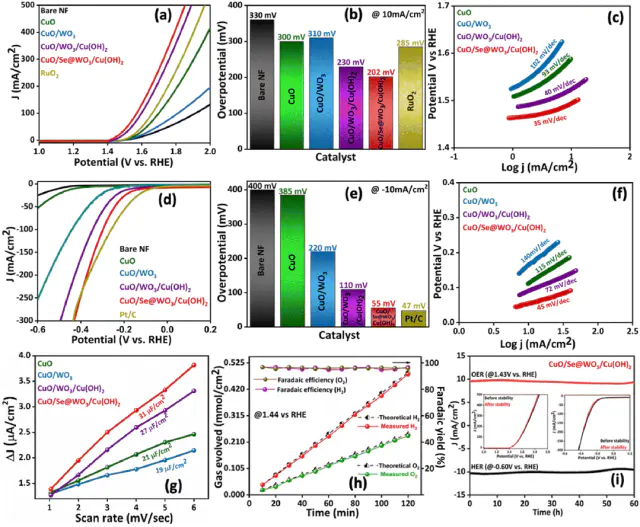
(a)OER的LSV极化曲线(b)10mA/cm2电流密度下的OER过电位(c)HER的LSV极化曲线(d)10mA/cm2电流密度下的HER过电位。DOI:10.1039/d5ta00627a
塔菲尔曲线(Tafel Plot)
:应用塔菲尔斜率 b 可判断极化类型 ——b≈120 mV/dec 对应活化极化(单电子转移步骤为 PDS),b≈40 mV/dec 对应多电子转移;a 值越小,催化剂活性越高。
其中,dec=“数量级”,即 j 每增加 10 倍对应的 η 变化。
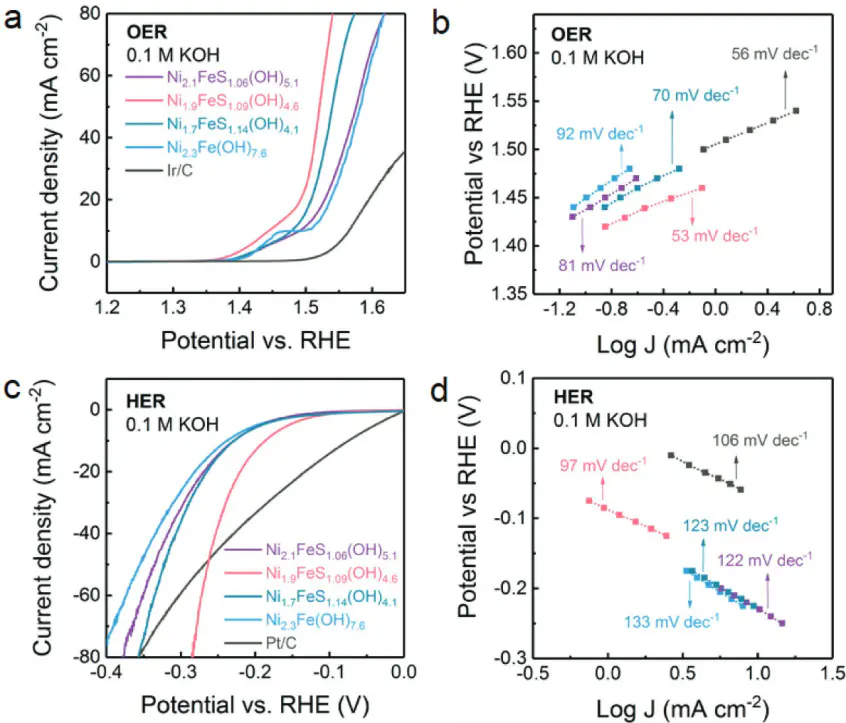
(a、b)OER的LSV极化曲线及其相对应的Tafel斜率(c、d)HER的LSV极化曲线及其相对应的Tafel斜率。DOI:10.1002/smtd.201800055
电化学阻抗谱(EIS)
:EIS 是唯一能定量分离不同电阻组分的方法,通过交流信号扰动,将总电阻拆成溶液电阻(Rs)、传质电阻(Zw应用Rct 越小,活化极化越低;Rs 越大,欧姆极化越高,可针对性优化(如更换高电导率电解质)。
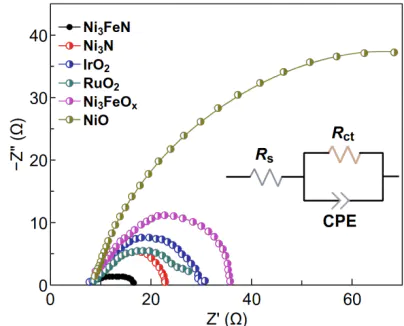
EIS电化学阻抗谱。DOI:10.1007/s40820-020-0412-8
理论计算
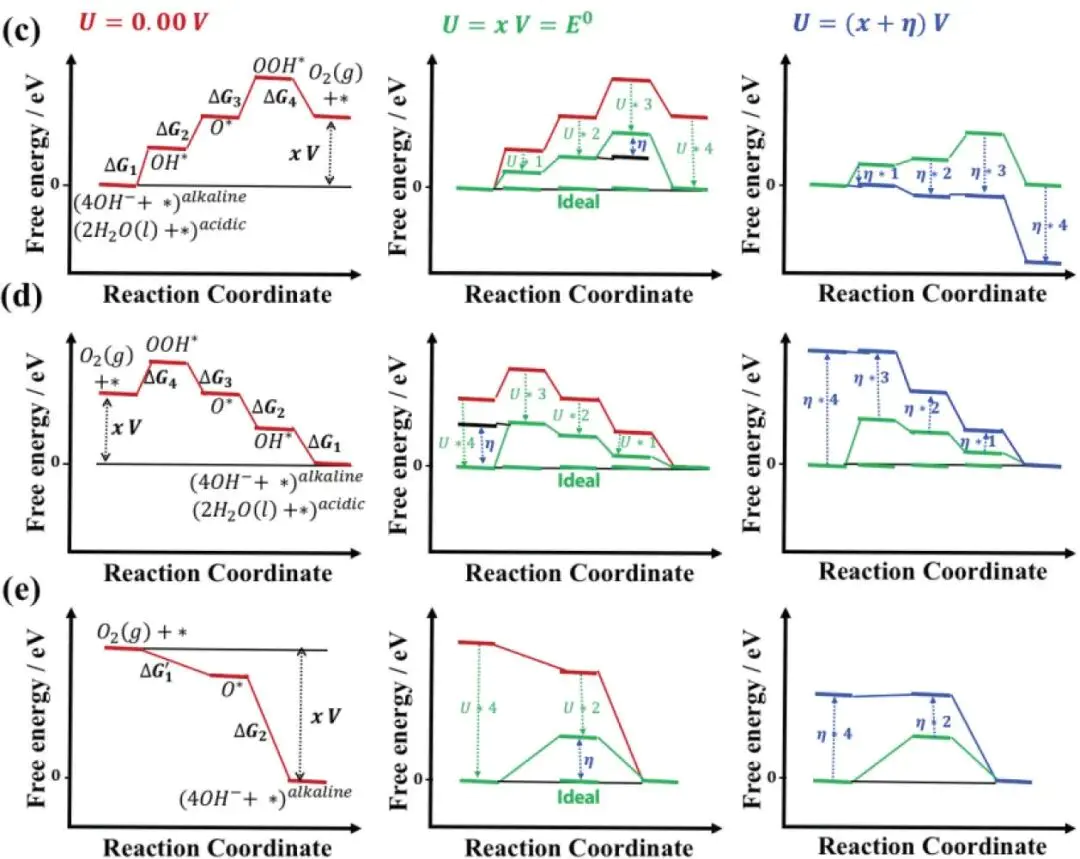
“OER 四步质子耦合电子转移(PCET)反应中,自由能变最大的步骤:电位决定步骤(PDS)所需的额外电位”过电位计算需先明确反应路径,以DOI:10.1021/acscatal.1c03737这篇文章为例,总反应的平衡电位为,对应总自由能变 ΔG 总 = 4.92 eV(4×1.23 eV)—— 这是过电位计算的 “热力学基准”,所有步骤的自由能均需以此为参照。
电位决定步骤PDS
=1.81 eV。
步骤 3:换算理论过电位
代入ΔGPDS=1.81 eV,得 η=1.81 V – 1.23 V=0.58 V。
注意:若施加外加电位 U,需确保所有步骤的 ΔG (U) ≤ 0(反应自发进行),此时最小 U 即为实际所需电位,过电位 η=U – 1.23 V
PDOS验证
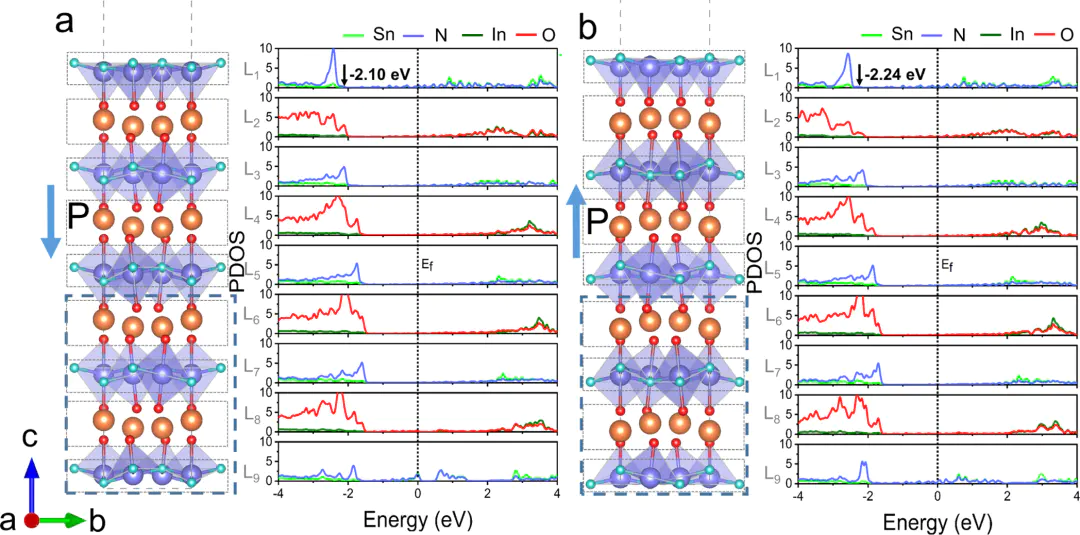
DOI:10.1021/acscatal.1c03737
下表显示,正极化表面的 Sn 原子净电荷为1.82 e,低于负极化表面1.87 e,N 原子净电荷在-1.40~-1.42 e,更负,证实了正极化表面电子密度更高—— 电子密度的差异直接导致中间体吸附强度变化,进而改变过电位。
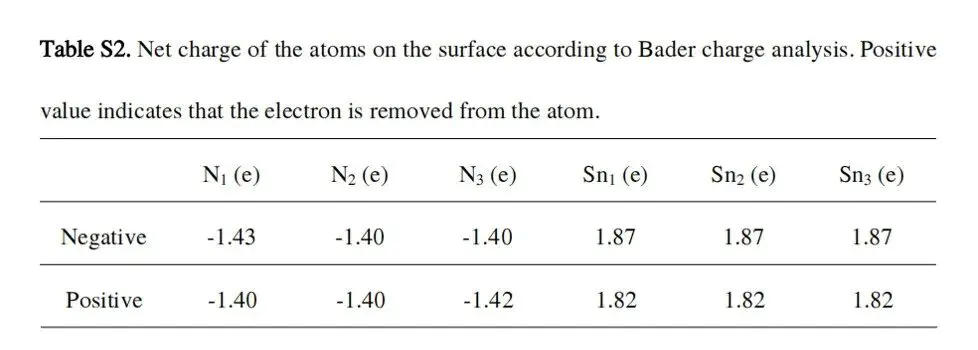
DOI:10.1021/acscatal.1c03737