基于该研究结果,SHR-A1811也成为目前我国HER2阳性晚期乳腺癌二线治疗领域,mPFS唯一突破30个月的新型ADC药物。为此,本报特围绕HORIZON-Breast01研究最新结果展开跟踪报道。

图1:2025 ESMO现场直击
高光时刻:ADC领域风起云涌,mPFS创纪录
HER2阳性乳腺癌约占所有乳腺癌的15%~20%,侵袭性强、预后较差2。随着医学技术的进步,以DS-8201为代表的ADC药物的出现,无疑为该类患者的治疗带来了突破性进展。然而除了疗效,其伴随的间质性肺病(ILD)、消化道不良反应(如恶心和呕吐)以及乏力等治疗相关不良事件(TRAEs),仍然是临床实践中不容忽视的挑战。在此背景下,如何持续提升ADC药物疗效以进一步提高生存获益,同时有效平衡其安全性管理以改善患者生活质量,已成为重要研究方向。
临床对于“更优解”的探寻从未止步,最新公布的HORIZON-Breast01研究显示,SHR-A1811组经盲法独立中心审查委员会(BICR)评估的mPFS达30.6个月(HR=0.22,95%CI:0.15-0.34,P<0.0001)(图2),直接创造了目前我国HER2阳性晚期乳腺癌二线治疗领域的新纪录;研究者(INV)评估结果mPFS为33.3个月(HR=0.16)。与此同时,SHR-A1811组的客观缓解率(ORR)高达81.7%,在目前已公开数据的同类ADC中继续领跑(图3)。安全性方面,SHR-A1811组ILD发生率极低,为2.8%(≥3级发生率0.7%)。SHR-A1811正以其卓越的疗效与良好的安全性,有望成为改变临床实践的理想治疗新方案1:
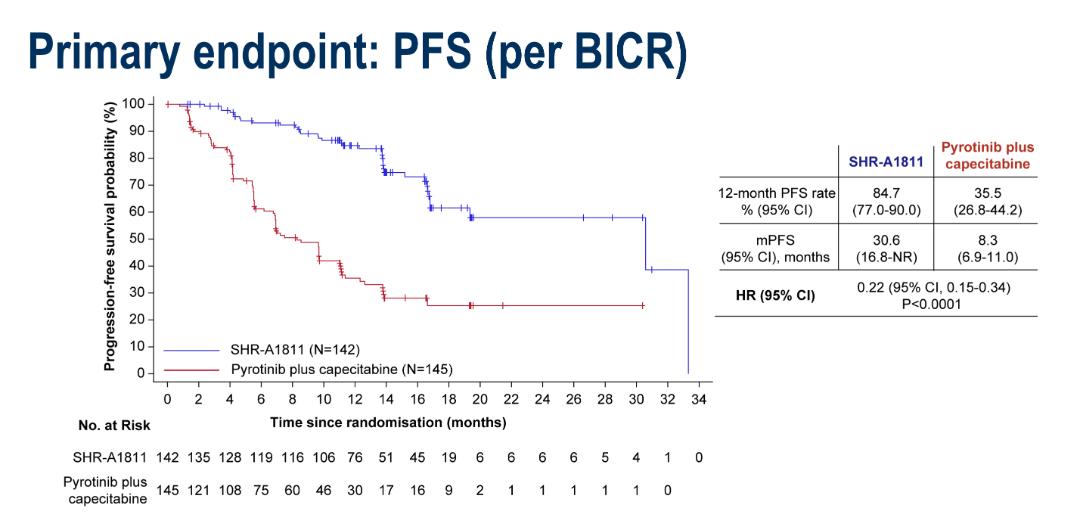
图2:PFS
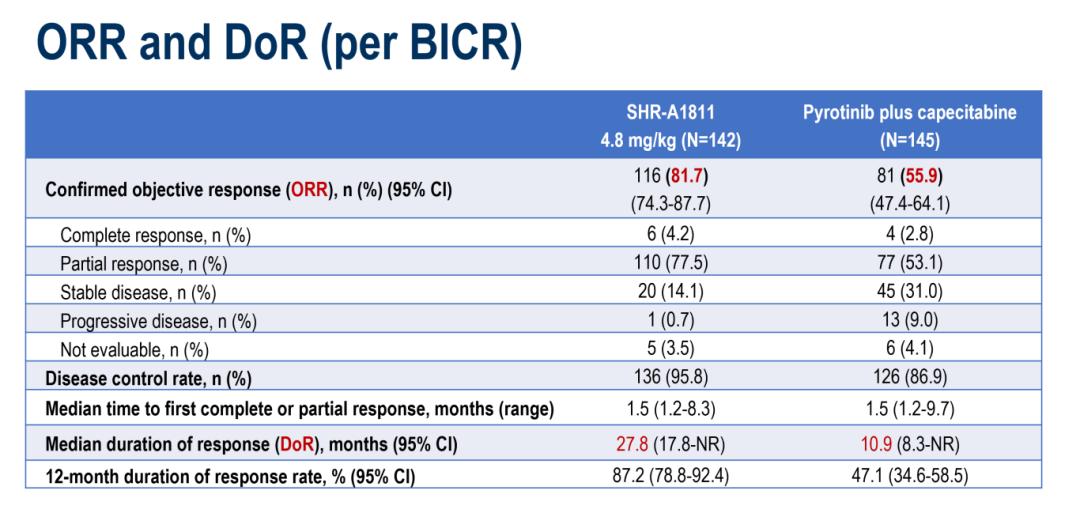
图3:ORR
破局攻坚:深耕中国临床实践,直面现实治疗难关
HORIZON-Breast011是一项多中心、开放标签、随机、Ⅲ期临床研究,入组了既往接受过曲妥珠单抗联合紫杉类治疗的HER2阳性晚期乳腺癌患者,按1:1比例随机接受静脉注射SHR-A1811或口服吡咯替尼联合卡培他滨治疗。主要终点为BICR评估的PFS,次要终点包括研究者(INV)评估的PFS以及总生存期(OS)、ORR、DoR及安全性等。预设分层因素为既往化疗线数和激素受体状态。(图4)
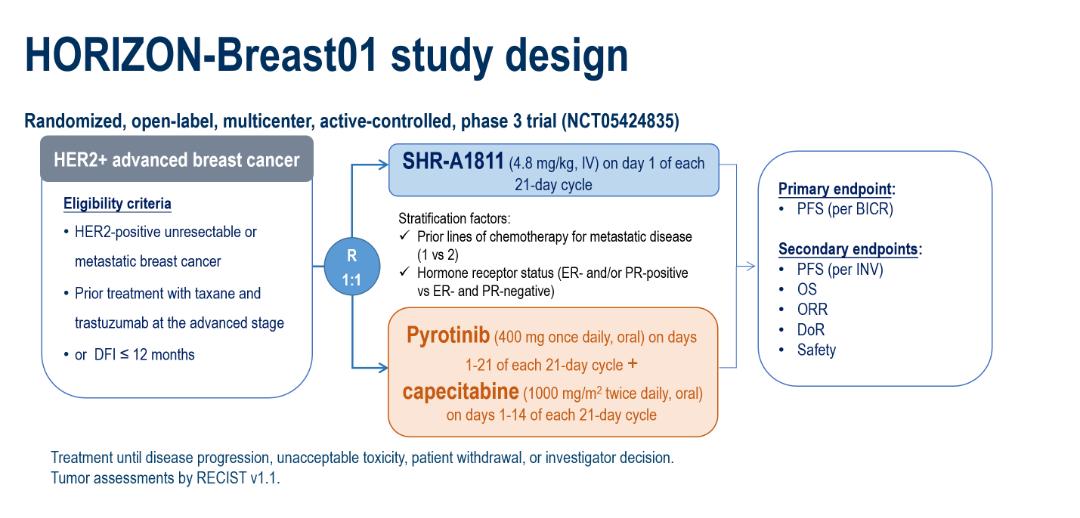
图4:研究设计
该研究的基线特征(详见图5)具有重要的临床实践价值,主要体现在以下方面:第一,研究人群高度贴合中国临床实际。SHR-A1811组纳入的142例患者全部为中国人群,其中71.8%曾接受过帕妥珠单抗治疗,真实反映了我国当下HER2阳性乳腺癌的治疗现状;第二,研究聚焦于临床难治人群,SHR-A1811组ER和/或PR阳性患者占比高达47.9%,此类患者通常预后较差;第三,该组中76.1%的患者合并内脏转移,肝转移38.7%,肺转移45.1%,脑转移4.9%,此类患者通常病情较重,进一步凸显了研究人群的高危特征。
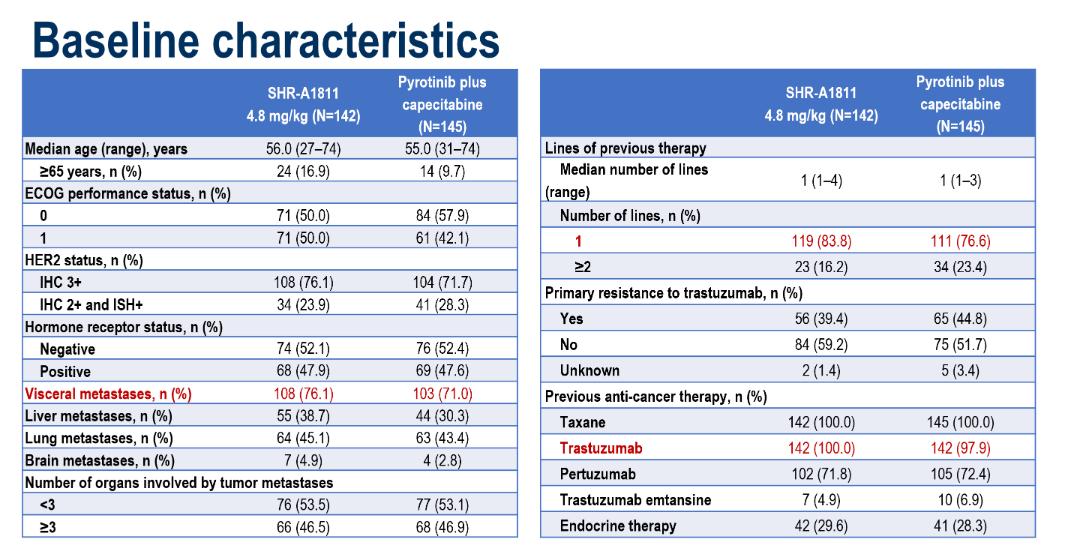
图5:基线特征
实力闪耀:亚组人群全面获益,难治人群优势凸显
该研究的PFS亚组分析显示,所有亚组均可从SHR-A1811治疗中获益(图6)。其中:对于既往接受过帕妥珠单抗治疗的患者,SHR-A1811组的mPFS为30.6个月(95%CI:16.7-NR);对于既往未接受过帕妥珠单抗治疗的患者,SHR-A1811组mPFS为33.3个月(95%CI:19.4-NR)(图6)。需要关注的是,本研究对照组mPFS为8.3个月,低于PHENIX/PHOEBE研究中超过12个月的结果。这一差异主要源于研究人群的差异:PHENIX/PHOEBE研究开展时帕妥珠单抗在国内尚未可及,入组患者均未接受过帕妥珠单抗治疗;而本研究纳入超过70%的帕妥珠单抗经治患者,更贴合当前临床实践格局。
对于ER和/或PR阳性类难治人群,SHR-A1811组mPFS高达33.3个月(HR=0.23),超过了整体人群的30.6个月。此外,在内脏转移患者亚组中,SHR-A1811组mPFS高达30.6个月(HR=0.24)。
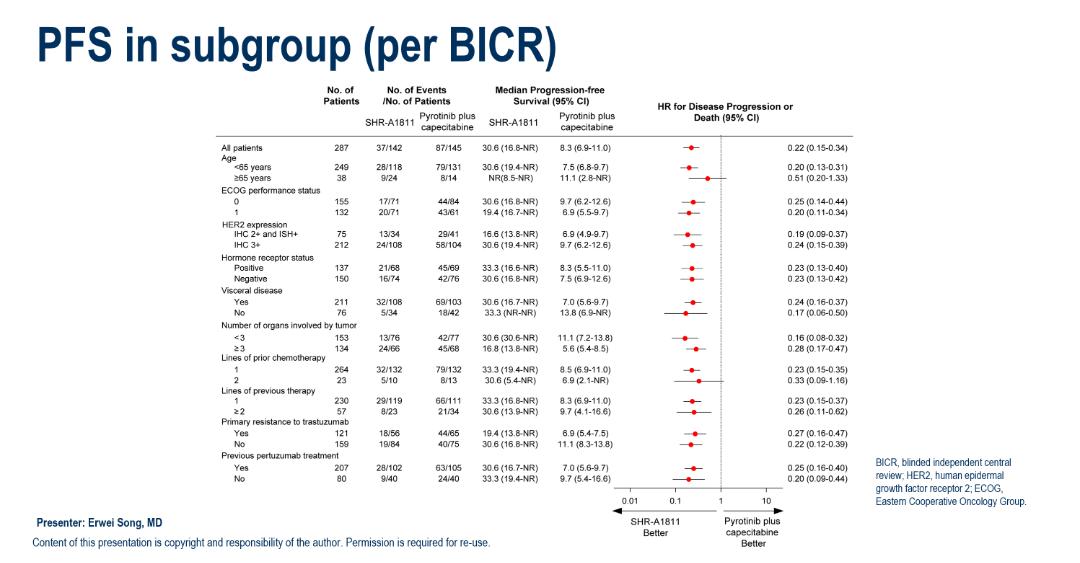
图6:亚组分析PFS
安心之选:ILD低至2.8%,可管可控可耐受
SHR-A1811组整体安全性良好,与既往SHR-A1811-101等研究数据一致,不良反应以血液学毒性为主,整体可管可控(图7和图8):
·消化道相关TRAEs发生率(恶心:64.1%,呕吐:32.4%),和消化道≥3相关TRAEs发生率(恶心:1.4%,呕吐:0.7%)均较低;
·疲劳乏力发生率
·治疗依从性较优:因TRAEs导致的永久停药率仅为4.9%,药物减量相关的TRAEs发生率为22.5%,提示患者耐受性良好,治疗持续性更有保障。
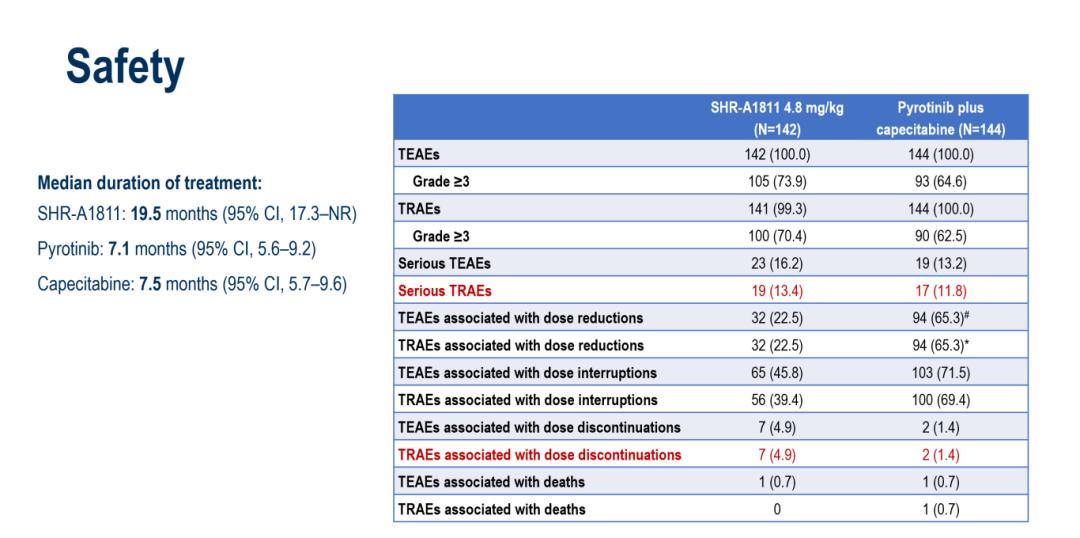
图7:安全性
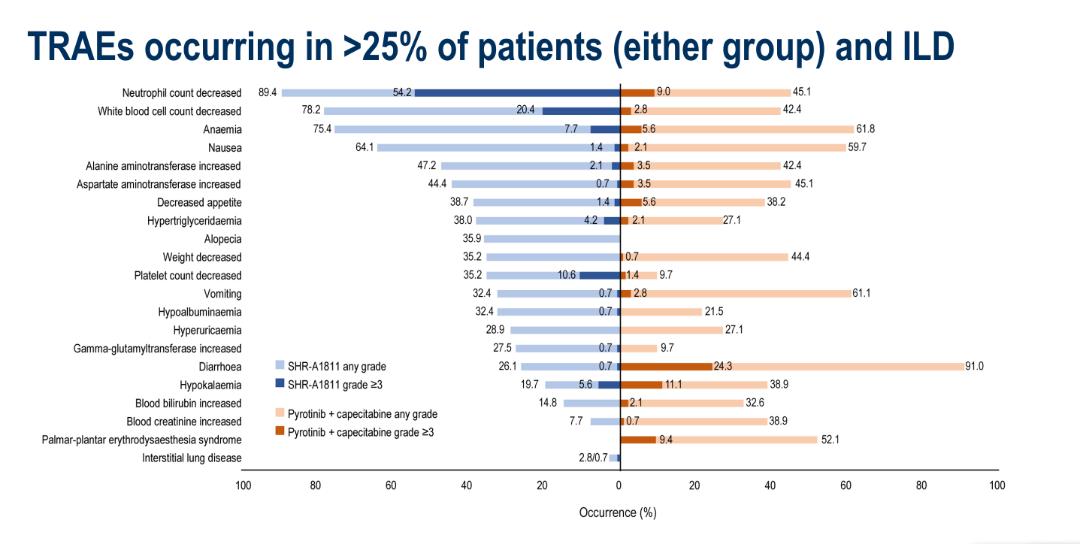
图8:治疗相关不良事件
再攀高峰:破未破之界,达未达之境
HORIZON-Breast01研究出色的结果离不开SHR-A1811的独特结构与机制优势。该药物由曲妥珠单抗、可裂解四肽链接子及拓扑异构酶I抑制剂共同构成,具备多项设计特点:引入环丙基增强毒素膜渗透性,有助于拓宽治疗窗;DAR值为6:1,平衡疗效与毒性风险;链接子–毒素系统稳定,降低提前释放风险,提升安全性。在机制层面,SHR-A1811在不同HER2表达水平的细胞中均表现出较低的细胞毒性药物半抑制浓度(IC50),抑瘤作用更强,且偶联过程未影响其与HER2受体的亲和力、内化效率及ADCC效应,展现出优异的抗肿瘤活性、膜穿透能力与旁观者效应3-4。
凭借HORIZON-Breast01研究的突破性成果,国产ADC药物在HER2阳性晚期乳腺癌治疗领域取得了重要进展。研究结果表明,无论是在整体患者人群,还是在ER和/或PR阳性、伴内脏转移等难治亚组中,均展现出显著的疗效优势与良好的安全性,充分体现了“中国智造”在创新药物研发方面的实力与国际竞争力。随着更多临床循证数据的积累,SHR-A1811的应用前景日益明朗,未来有望成为改变临床实践格局的理想治疗方案,为HER2阳性乳腺癌患者带来更长生存与更优获益。
除HORIZON-Breast01研究外,SHR-A1811已在多项临床研究中全面布局,不断拓展其临床应用边界,逐步构建乳腺癌全程治疗新体系,如探索SHR-A1811在HER2阳性早期乳腺癌领域作为辅助治疗疗效和安全性的HORIZON-Breast05研究、探索HER2低表达不可切除或转移性乳腺癌中SHR-A1811疗效和安全性的HORIZON-Breast06研究、探索SHR-A1811联合帕妥珠单抗加或不加达尔西利和内分泌治疗在HER2阳性晚期乳腺癌中疗效与安全性的HORIZON-Breast07研究以及探索三阴性乳腺癌领域SHR-A1811联合免疫治疗疗效与安全性的HORIZON-Breast13研究等5。
参考文献:
1. SHR-A1811 versus pyrotinib plus capecitabine in human epidermal growth factor receptor 2-positive (HER2+) advanced/metastatic breast cancer (BC):a multicenter, open-label, randomized, phase 3 study (HORIZON-Breast01).ESMO 2025:LBA19.
2. Tarantino P, Hamilton E, Tolaney SM, et al. HER2-Low Breast Cancer: Pathological and Clinical Landscape. J Clin Oncol. 2020;38(17):1951-1962.
3. Ting. Z, et al. 2023 AACR LB031;
4. Ting. Z, et al. Research Square: doi.org/10.21203/rs.3.rs-3770094/v1.
5.
本文由河南省人民医院副主任医师司丕蕾审校