华算科技的定义、形成原理及分类共价键离子键金属键配位键的定义与形成原理分子几何结构示意图。
化学键是原子之间通过电子相互作用而形成的力,它使得原子可以以不同的方式结合在一起,形成分子或化合物。根据形成化学键的不同机制,化学键可以分为几种类型,包括。
原理,化学键的本质是通过电子云的重叠,促使电子间的引力作用大于排斥作用,从而降低系统的能量,使得分子趋向于稳定。
当两个原子靠近时,它们的电子轨道开始重叠,形成一个共用的电子云,这种电子云的重叠会产生吸引力,从而使原子相互结合形成共价键。图1. 左图为中心的硅原子与周围四个硅原子各共享一个电子,形成共价键;右图为键合图。
离子键的形成通常发生在金属与非金属元素之间,由于金属原子失去电子形成阳离子,非金属原子获得电子形成阴离子,两者之间的静电相互作用便形成了离子键。与共价键不同,离子键的形成并不依赖于电子的共享,而是依赖于电子的转移。
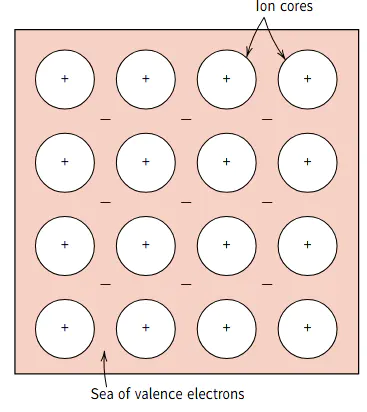
金属键主要存在于金属元素之间,是通过金属原子中自由电子的流动形成的(如图3所示)。金属键的特殊性在于,,这些自由电子在金属晶体中流动,使得金属原子间通过这些自由电子的吸引力相互结合。
配位键则是一种由一个配体提供一对孤电子与金属中心原子或离子之间形成的键。图4.DOI: 10.1039/d3qi02250a
什么是杂化轨道
这一理论模型的提出是为了弥补传统轨道理论中存在的缺陷,即简单的原子轨道重叠并不能有效解释分子的几何结构和化学键的实际特性。
s轨道和p轨道等并不是独立地参与成键,而是通过数学上的线性组合,。
能量最小化图5. sp3杂化轨道理论的一个核心假设是,在成键过程中,原子轨道的混合方式使得新的轨道不仅能量较低,而且空间排列有利于分子的几何结构。通过这种方式,原子之间的化学键能够以较高的效率形成,且分子的几何结构能与实际观测相符。
在杂化轨道理论中,最常见的几种杂化类型包括sp³杂化sp杂化(如图6所示)这种组合生成了两个相同能量的杂化轨道,它们的空间排列是线性的,形成的键角为图6. sp杂化轨道形成过程及示意图。
是由一个s轨道和两个p轨道的组合所产生的,生成三个相同能量的杂化轨道这三个杂化轨道相互之间的角度为图7.轨道示意图。
(如图8所示)109.5°。这种杂化常见于四面体结构的分子中,是最常见的杂化形式,能够描述大多数简单有机分子的结构。
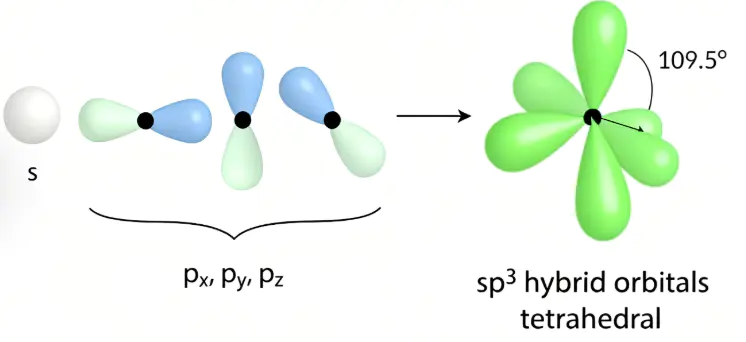
sp³除了这些基础的杂化方式,还有如,这些杂化类型主要出现在过渡金属化合物中,涉及到d轨道的参与,通常对应于五配位或六配位的分子几何结构。