对于许多晚期实体瘤患者来说,在看到CAR-T细胞疗法有效缓解血液系统肿瘤患者的病情时,需要新疗法的心变得更加迫切。2024年,首款用于实体肿瘤的TIL疗法终于获美国食品药品监督管理局(FDA)批准上市,成为近年来最具潜力的实体瘤治疗技术之一。
这款自20世纪就开始探索的疗法,利用肿瘤内部的肿瘤浸润淋巴细胞(TILs)来实现对肿瘤的精准打击。
这些细胞已经成功识别并侵入肿瘤组织,但通常数量不足或被免疫抑制机制所限制。TIL细胞疗法便是经过体外扩增这些细胞后回输体内,由于这些对肿瘤抗原非常熟悉,能够识别多种肿瘤抗原,因此避免了CAR-T疗法需要寻找单一靶点的局限性。

首款实体瘤TIL疗法终获FDA批准
经过多年努力,美国Iovance公司的TIL疗法Amtagvi(Lifileucel)终于在2024年2月获得FDA批准上市。
这款疗法在晚期黑色素瘤中的客观缓解率(ORR)达到31.4%,更有令人鼓舞的长期数据:31.3%的响应者在接受一次治疗后缓解持续超过5年。
在非小细胞肺癌领域,Lifileucel也展现出突破性进展,疾病控制率(DCR)高达71.8%,为这些难治患者提供了新的选择。
TIL技术创新
传统TIL疗法存在生产周期长、成本高、需要联合大剂量IL-2注射,以及患者需要接受高强度清淋化疗等挑战。如今,国内外多家生物科技公司正在通过技术创新,让TIL疗法变得更安全、更有效、更可及。
在工艺上,非滋养细胞培养体系和全封闭自动化生产提高了产品标准化程度和生产效率;
在技术上,基因编辑技术的应用进一步增强了TIL细胞的抗肿瘤活性和持久性;
在临床方案上,低强度清淋和低剂量IL-2甚至无IL-2方案的出现,显著改善了患者的安全性和耐受性;
这些创新使得TIL疗法正从“高度个性化的复杂治疗”转变为“可复制、可推广、可负担”的实体瘤免疫方案。
中国TIL疗法突破
尽管中国TIL疗法暂未有产品上市,但国内企业通过技术创新,正在实现“后来者居上”的跨越。
君赛生物的GC101是全球首款无需高强度清淋预处理、无需IL-2注射的TIL疗法,显著降低了治疗毒副作用和医疗成本。
在临床应用中,GC101在晚期非小细胞肺癌中客观缓解率达到41.7%,疾病控制率66.7%。
更令人振奋的是,一例复发性胶质母细胞瘤患者经GC101治疗后,复发病灶完全清零,持续完全缓解已将近两年。

图片来源于君赛生物
华赛伯曼的FAST-TIL(HS-IT101)则攻克了传统TIL生产周期长的难题,将制备时间从常规的22-28天缩短至14天,并且样本需求量大幅减少。
在晚期黑色素瘤患者中,FAST-TIL显示出50%的客观缓解率,疗效优于美国已上市同类产品。
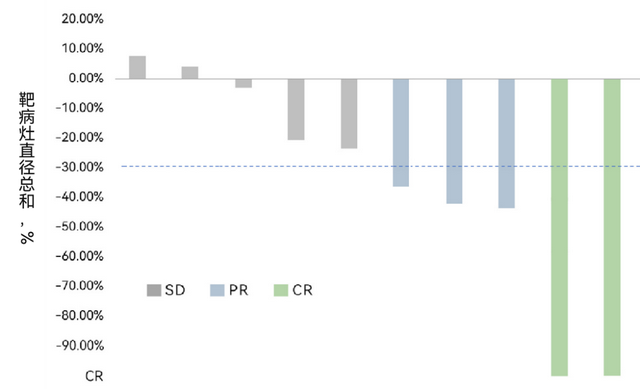
图片来源于华赛伯曼
沙砾生物的GT307采用CRISPR基因编辑技术,成为全球首个在“冷肿瘤”(免疫细胞浸润少的肿瘤)中显示疗效的TIL产品,旨在解决实体瘤治疗中TIL在肿瘤微环境中易发生功能耗竭、持续性不足等关键瓶颈问题。
百吉生物研发的BST02注射液是全球首个针对肝癌的临床阶段TIL产品,突破了传统TIL药物对距离和时间的限制,并且无需高剂量白介素-2(IL-2)辅助用药。临床试验显示疾病控制率(DCR)高达100%,反应最佳的患者肝脏多处靶病变减少了57.1%。
因此对于标准治疗失败或缺乏有效治疗方案的实体瘤患者,TIL疗法可能是一条值得考虑的新路径。
结语
目前,国内多款TIL疗法已进入临床阶段,针对黑色素瘤、非小细胞肺癌、宫颈癌、头颈部鳞癌等多种实体瘤的临床试验正在积极开展。对于标准治疗无效的晚期实体瘤患者,TIL疗法可能是一个重要的选择方向。随着技术的不断进步,TIL疗法正朝着更安全、更有效、更可及的方向发展。TIL疗法与PD-1抑制剂等免疫检查点抑制剂的联合使用,正在探索中并已显示出协同增效作用。未来几年,我们将见证更多TIL产品上市,造福广大实体瘤患者。