在癌症治疗领域,细胞免疫疗法是癌症免疫治疗中一种颇具吸引力的方法。该疗法利用基因工程技术改造T细胞,赋予其识别和杀死肿瘤细胞的能力。其中,嵌合抗原受体T(CAR-T)细胞疗法和T细胞受体(TCR)工程化T细胞疗法近年来在抗肿瘤方面展现出了令人鼓舞的效果。与CAR-T细胞疗法在血液恶性肿瘤显示出令人振奋的疗效,但实体瘤中的效果不尽如人意的结果不同,TCR-T细胞疗法在治疗实体瘤方面显示出广阔的前景。
关于TCR-T细胞疗法
TCR-T细胞疗法是一种过继性细胞转移疗法,它利用人体自身的免疫系统来对抗癌症。“TCR”代表T细胞受体,这是免疫防御系统的关键组成部分,使T细胞能够识别并应对特定的威胁。通过改造这些受体,科学家可以创造出大量高度特异性的抗癌细胞,这些细胞比天然受体更擅长识别和消除肿瘤细胞。
T细胞受体是位于T细胞表面的蛋白质复合物,相当于这些免疫细胞的“眼睛”。它们在体内扫描异常信号,如入侵者或异常细胞的存在。在癌症背景下,T细胞受体已被改造以识别肿瘤相关抗原(TAAS),这些抗原要么是癌细胞特有的,要么在正常细胞中的表达水平极低。然而,癌细胞非常狡猾,往往会进化出逃避免疫系统检测的机制。这就是工程改造在TCR-T疗法中发挥关键作用的地方。
研究人员筛选出对癌症相关抗原具有天然亲和力的TCR,然后对这些受体进行“升级”:增强其与抗原结合的能力,触发更强的免疫反应。这就像给免疫细胞装上了高倍望远镜,让它们能发现原本可能被忽略的癌细胞。
相比天然TCR,工程化TCR通常具有以下特征:
1.更高的抗原亲和力;
2.更强的稳定性,能在恶劣的肿瘤微环境中保持功能;
3.有时还能识别正常免疫系统忽略的抗原,从而扩大潜在的抗癌靶标范围。
TCR-T与CAR-T
尽管TCR-T疗法和CAR-T疗法之间存在相似之处,但它们在技术手段上存在根本差异。CAR-T疗法通过基因工程使T细胞表达嵌合抗原受体(CAR),从而直接识别癌细胞表面的特定蛋白。相比之下,TCR-T疗法则是改造T细胞使其表达T细胞受体(TCR),以识别癌细胞表面主要组织相容性复合体(MHC)分子呈递的蛋白片段。换言之,CAR-T可以直接“看到”细胞表面的蛋白,而TCR-T则还可以“读取”MHC呈递的内部蛋白信息。
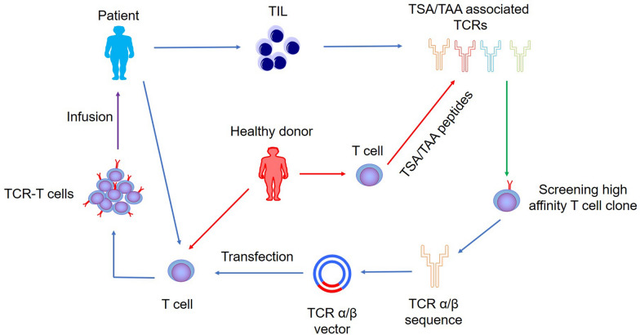
TCR-T的治疗流程
1.确定靶抗原:寻找癌细胞特有或主要表达的蛋白质,如同“大海捞针”,却关乎生死。
2.T细胞采集与改造:从患者血液中提取T细胞(白细胞分离术),然后在实验室内对其进行基因改造,使其表达针对目标抗原的工程化TCR。
3.T细胞扩增:在严格控制的条件下大量培养这些改造后的T细胞,形成一支“抗癌大军”。
4.质量控制:确保这些细胞具备识别目标、维持活性且不会引发意外副作用的能力。
5.回输患者体内:将数十亿经过精心设计的免疫细胞重新注入患者体内,开始寻找并消灭癌细胞。
6.治疗监测:治疗后密切观察患者的反应与副作用,确保疗效与安全。
近日,2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林盛大召开,会上公布了肿瘤学领域的多项前沿研究成果。其中,新景智源靶向KRAS G12V突变的自体TCR-T细胞治疗候选产品NW-301V注射液、Immatics公司针对PRAME的TCR-T细胞疗法以及星汉德生物的SCG142 TCR-T细胞疗法备受关注。这些产品分别在晚期结直肠癌、胰腺癌、转移性葡萄膜黑色素瘤和HPV相关癌症的治疗中展现出了良好的效果,验证了TCR-T技术在实体瘤中的可行性。
新景智源NW-301V:靶向KRAS突变,挑战胰腺癌与结直肠癌
NW-301V注射液是新景智源一款靶向KRAS G12V突变的自体TCR-T细胞治疗候选产品,此次会议上公布了NW-301V在转移性结直肠癌和胰腺癌患者中开展的首个人体、研究者发起的1期临床试验的初步结果。截至2025年2月28日,DL1和DL2剂量组已完成入组,共纳入8例患者,DL1和DL2剂量组分别有4例患者,均为胰腺癌/结直肠癌。

总体客观缓解率(ORR)为37.5%(3/8),疾病控制率(DCR)为62.5%(5/8)。共3例患者实现部分缓解(PR),包括DL1剂量组1例胰腺癌患者以及DL2剂量组的2例结直肠癌患者。2例患者病情稳定(SD),均为DL2剂量组的结直肠癌患者。
DL2剂量组(结直肠癌)客观缓解率(ORR)达50%(2/4),疾病控制率(DCR)高达惊人的100%(4/4),即所有结直肠癌患者均实现肿瘤控制(部分缓解或稳定)。更值得关注的是,2例患者在治疗4周时评估为疾病稳定(SD),至8周时肿瘤进一步缩小达到部分缓解(PR)。所有达到部分缓解或疾病稳定的患者,其疗效均持续超过3个月。
初步研究结果证实,NW-301V在KRAS G12V突变的胰腺癌和结直肠癌中表现出良好的安全性和有希望的抗肿瘤活性。
IMA203:攻转移性葡萄膜黑色素瘤,确认客观缓解率达67%
Anzu-cel(anzutresgene autoleucel,IMA203)是一种针对PRAME的TCR-T细胞疗法,旨在识别由HLA-A*02:01在细胞表面呈递的细胞内PRAME衍生肽段,并引发强效且特异性的抗肿瘤免疫反应。在ESMO 2025年会上,Immatics公布了IMA203针对转移性葡萄膜黑色素瘤的1b期临床数据。这项临床试验结果显示,16例患者中有14例存在肝脏靶病灶,IMA203治疗后肝脏靶病灶中位缩小了49.6%。
确认客观缓解率(cORR)为67%(10/15),疾病控制率(DCR)为88%(14/16),中位缓解持续时间(mDOR)为11个月(最短4.4个月,最长31.6个月),中位无进展生存期(mPFS)为8.5个月,6个月PFS率为69%,12个月为39%。中位总生存期(mOS)尚未达到,12个月OS率为71%。在肝脏及肝外转移灶(包括肺、淋巴结、腹部/腹膜等)中均观察到抗肿瘤活性。

安全性方面:在葡萄膜黑色素瘤中耐受性良好,与IMA203整体安全性特征基本一致。最常见的治疗中出现的不良事件(TEAEs)为与淋巴细胞清除相关的预期性血细胞减少。预期且可控的细胞因子释放综合征(CRS)主要为1级或2级,与其作用机制相符。没有患者出现长期CRS,大多数CRS在14天内缓解。未观察到与anzu-cel相关的5级事件。
数据表明,IMA203在转移性葡萄膜黑色素瘤患者中具有持续强大的抗肿瘤活性和持久性。
星汉德生物SCG142:精准打击HPV相关癌症,100%疾病控制率
星汉德生物在ESMO上公布的SCG142初步数据同样引人注目。这款疗法针对的是人乳头瘤病毒(HPV)相关癌症。在这项I期试验中,SCG142展现出100%的疾病控制率,所有患者均观察到肿瘤缩小,其中4例患者(57%)肿瘤缩小超过30%。

安全性方面更是令人惊喜,所有治疗相关不良反应均为1-2级,所有参与临床试验患者均未出现任何剂量限制性毒性、3级及以上不良反应、严重不良反应或免疫效应细胞相关神经毒性综合征。
该试验数据证明了SCG142在实体瘤中的有效性,有可能为HPV相关癌症患者提供全新的治疗选择。
结语
TCR-T细胞疗法在实体瘤的临床试验中展现出了极具吸引力的前景。尽管TCR-T疗法潜力巨大,但生产过程耗时、费力且昂贵,因此TCR-T细胞疗法仍面临多种挑战。目前,TCR-T疗法的临床试验正在全球范围内迅速展开,涵盖黑色素瘤、肉瘤、宫颈癌、肝癌等多种癌症类型。相信随着技术的不断进步,TCR-T疗法将逐步迈向更加精准、高效和个性化的未来,为长期以来选择有限的患者提供新的生命希望。