2025年10月10日温州医科大学徐军军博士(通讯作者)团队在国际知名期刊Nature合作期刊系列《npj cardiovascular health 》发表题为" Metabolic Regulation for the Treatment of Ischemic Heart Disease with Stem Cells and Extracellular Vesicles"(干细胞及外囊泡治疗缺血性心脏病代谢调控)的综述性文章。原文链接:https://www.nature.com/articles/s44325-025-00089-z

研究背景:缺血性心脏病(IHD)主要由冠状动脉粥样硬化或功能障碍所致,导致心肌缺血缺氧,临床表现包括胸痛及心肌梗死(MI)等。IHD在全球范围内构成显著的疾病负担,中国每年因IHD死亡人数超过数百万人。急性心肌梗死(AMI)是IHD最严重的表现形式,伴随不良重塑,约14–36%的AMI可进展为心力衰竭(HF)。治疗后的五年生存率仅约50%,IHD是HF的主要危险因素,也是HF发病年龄偏早的最常报道原因之一。心肌细胞的再生能力显著降低且随年龄下降,因此减少心肌损失或促进再生被视为治疗IHD的潜在策略。鉴于干细胞具有独特的自我更新与分化能力,被认为是潜在的治疗性干预,尤其在急性心肌梗死和顽固性心绞痛中显示出潜力。近年来对IHD发病生理机制的研究表明,缺血性心肌中存在代谢重塑。这种重塑不仅导致能量不足,还与能量代谢以外的关键过程紧密相关,涉及细胞生长、抗氧化防御与凋亡等。因此,调控心肌细胞代谢已成为一项新兴的治疗方向。IHD的危险因素在疾病发作前即可诱导心肌代谢紊乱,如高血糖引发的胰岛素抵抗,导致葡萄糖利用下降而脂肪酸利用增加。心肌缺血后,代谢过程更为复杂;如短暂缺血后会出现脂质与碳水化合物代谢的紊乱。因此,对心肌细胞代谢的干预可能成为关键治疗策略。干细胞在调控心肌代谢方面的作用已获得多项研究支持,本文综述IHD中的病理代谢改变,以及干细胞及其外泌体(EVs)如何通过改善病理代谢来促进心肌修复。

图1.缺血性心脏病心肌细胞的底物代谢改变、治疗策略及干细胞在代谢调控中的作用。葡萄糖、游离脂肪酸、β-羟基丁酸及支链氨基酸进入心肌细胞并经代谢生成乙酰辅酶A(acetyl‑CoA),随后进入三羧酸循环。该循环产生的还原当量供给电子传输链以生成ATP。增强葡萄糖、支链氨基酸和酮体代谢可在缺血性心肌中发挥心肌保护作用。当前关于干细胞治疗缺血性心脏病的研究,主要聚焦于葡萄糖代谢的调控。蓝底框中的酶代表通路中的关键调控点。红、蓝、紫箭头分别指示IHD中的病理性代谢变化、干细胞诱导的代谢变化以及治疗策略。双箭头表示双向调控。
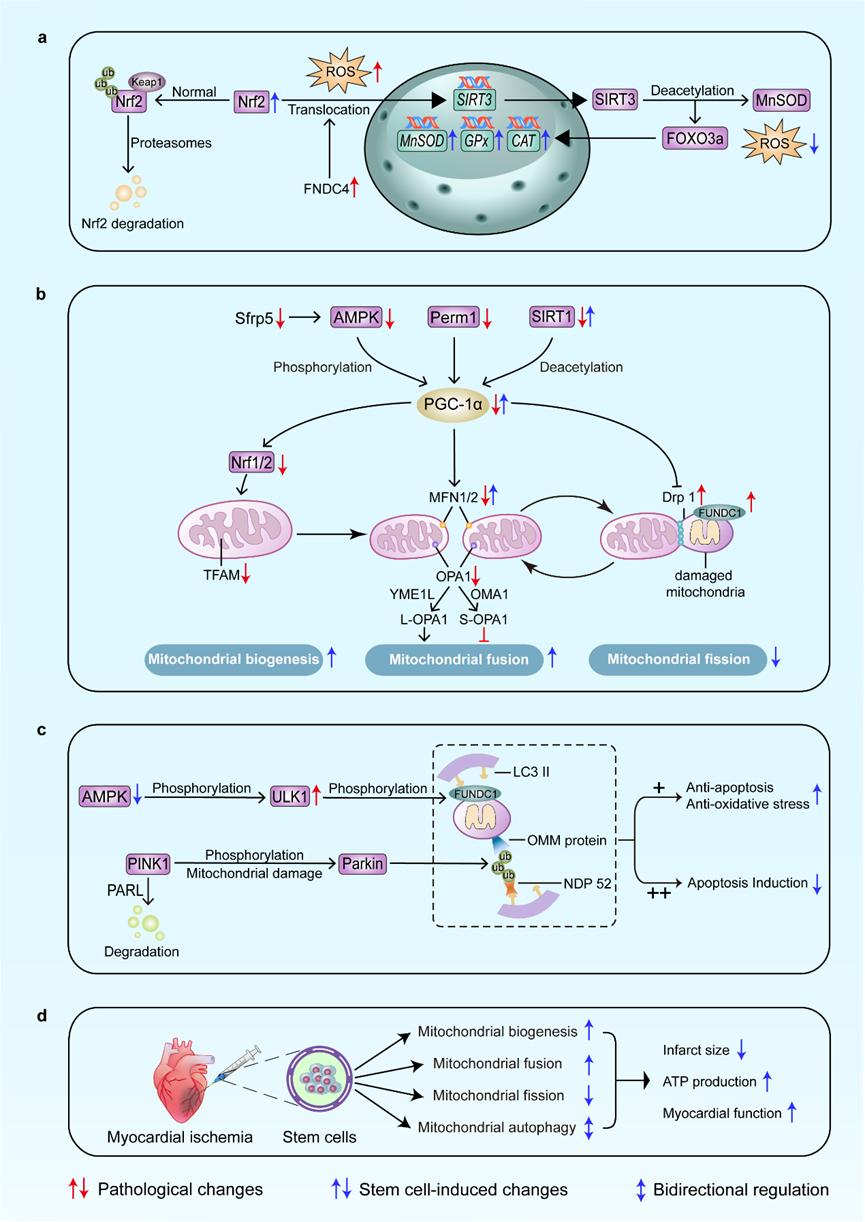
图2. 缺血性心脏病心肌线粒体代谢调控机制及移植干细胞的调控作用。a) 线粒体氧化应激的调控靶点。Keap1/Nrf2通过促进抗氧化酶表达以缓解氧化应激。 b) 线粒体动力学的调控靶点:Nrf1 促进线粒体生物发生;MFN1/2 促进融合,Drp1 促进分裂。c) 线粒体吞噬的调控靶点:ULK1 增强自噬;需要强调的是,AMPK/PGC-1α 在上述过程中的调控作用至关重要。 d) 干细胞通过促进线粒体生物发生、促进融合、降低分裂和减轻氧化应激来有助于降低梗死面积并恢复 ATP 水平;不过,其对自噬的影响仍存在争议。 红色箭头表示 IHD 的病理性代谢变化,蓝色箭头表示干细胞诱导的代谢变化;双向箭头指示双向调控。
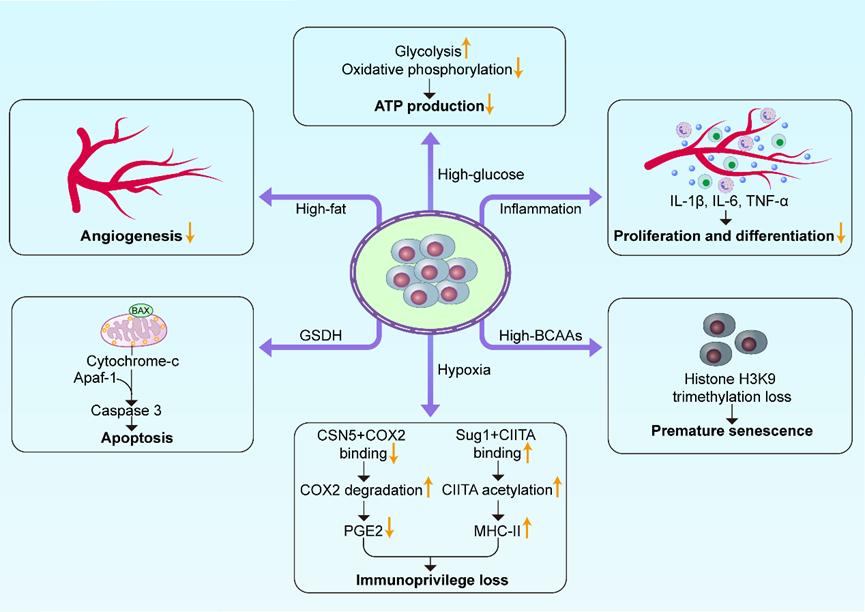
图3. 缺血性心脏病心肌微环境对移植干细胞的影响。缺血后心肌微环境(如高脂状态、炎症)通过诱导代谢失衡、免疫功能丧失、凋亡、早衰、血管生成能力受损以及增殖/分化潜能下降等途径,削弱移植干细胞的存活与修复功能。黄色箭头表示上调(↑)或下调(↓)。
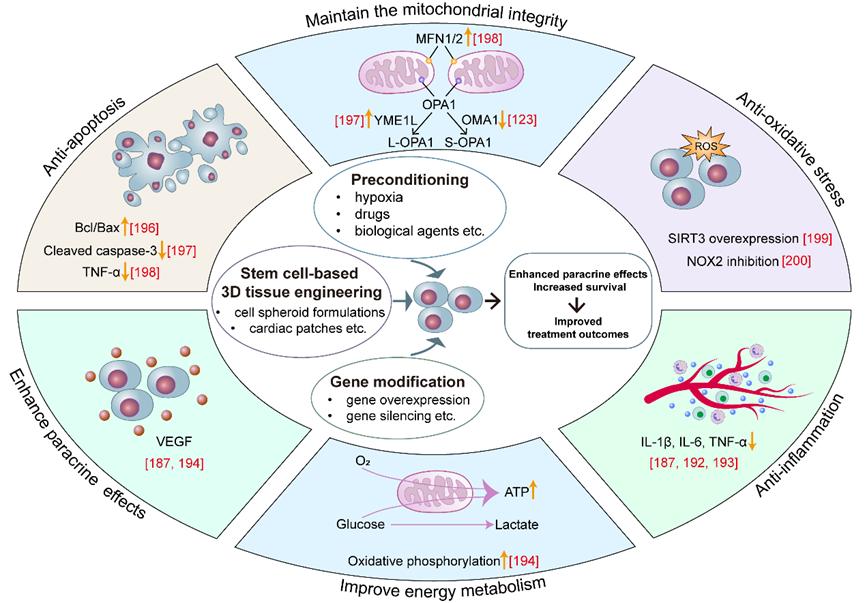
图4. 增强移植干细胞对缺血性心脏病微环境的适应性。增强干细胞移植前的预处理、基因修饰或基于干细胞的三维培养可提升存活率与旁分泌效应,从而改善治疗效果。增强移植干细胞关键机制包括抗炎、代谢增强、抗凋亡和抗氧化应激。黄色箭头表示上调(↑)或下调(↓)。
徐军军博士简介: 徐军军毕业于中国农业大学获得理学博士学位,长期从事新型干细胞应用开发及人工器官制造研究。现就职于温州医科大学,任课题组组长,该团队聚焦新型干细胞治疗缺血性心血管系统疾病的临床应用研究,以及结合生物材料、类器官、循环器官培养、组织工程构建大尺寸人工器官的研究。热诚欢迎产业界临床应用转化合作,Email:xujunjunyls@aliyun.com; Tel:18500080859 (同微信)。
— END —

新干细胞者说
- 科普 情怀 责任 -