近来临床上遇到了很多重症胰腺炎机械通气的患者,其中病理改变、呼吸机的模式、参数与常规RICU呼吸衰竭患者有一些不同,如腹内高压、血管容量不足、腹内高压对通气的影响等,本着不懂就学的原则,本期就整理下胰腺炎对肺部影响以及机械通气时注意事项。
·一、为什么胰腺炎患者的通气与众不同? ·
急性胰腺炎的常见病因主要包括胆道疾病、酒精(西方第二大诱因)以及高血脂(我国第二大诱因)。
其发生时胰蛋白酶催化胰酶系统、激活补体和激肽系统,产生大量炎症因子如TNF-α、IL-6以及IL-8等,导致胰腺局部组织炎症反应,引起血管壁损伤、血管渗透性增高、血栓形成和微循环灌注不足;
发生重症胰腺炎时,出现明显的胰腺缺血表现,缺血程度与坏死的范围呈正比,提示微循环障碍在重症胰腺炎发病中起重要作用。另外,急性胰腺炎发生后因为瀑布级联反应引起全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),导致白细胞趋化、活性物质释放、氧化应激、微循环障碍以及细菌易位等,导致靶器官/组织功能障碍或衰竭,肠屏障功能障碍及肠道衰竭、急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、肝肾功能衰竭、循环功能衰竭以及胰性脑病等,一旦发生多器官功能衰竭,病死率显著增加。
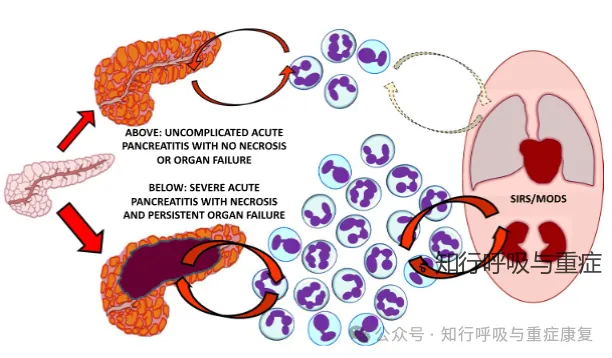
图1 轻症急性胰腺炎VS重症急性胰腺炎(引自2022,Acute Pancreatitis: Diagnosis and Treatment)
· 1.1 SAP的血流动力学变化·
重急性胰腺炎(SAP)发生时的循环功能改变以血液分布异常为特点,循环容量不仅因为局部渗出、腹水、呕吐等原因而绝对不足,而且由于血管的异常扩张导致相对不足。从而可以表现为心动过速、少尿、休克等。应首先根据临床表现密切注意循环容量的改变,及时进行血流动力学状态的监测,有效地指导早期治疗中的容量复苏及整个治疗过程中的精细容量调节。
SAP早期的血流动力学改变并非单纯低血容量所致,SAP早期心率和心指数升高,同时外周血管阻力下降,与感染性休克有相似的血流动力学表现;与血流动力学障碍伴随的还有动静脉氧分压差增加、肺内分流增加和显著低氧血症。上述变化特点提示,除低血容量导致血流动力学障碍外,还有血管活性物质和细胞因子释放等多种炎性因素参与其中。因此,SAP早期就可能存在内皮损伤和毛细血管渗漏,低血容量和组织灌注不足未被及时纠正,会导致代谢性酸中毒和严重毛细血管渗漏发生。
· 2 SAP的腹内压变化·
SAP由于其腹腔内及后腹膜大量渗出、腹腔内器官的间隙水肿、肠麻痹、胰腺坏死或伴感染以及合并腹腔内大出血形成腹腔内高压。腹内高压会引起或加重脏器功能障碍,最常受累的是心、肺和肾脏,并进一步引起肝、肠道和脑功能障碍或紊乱。
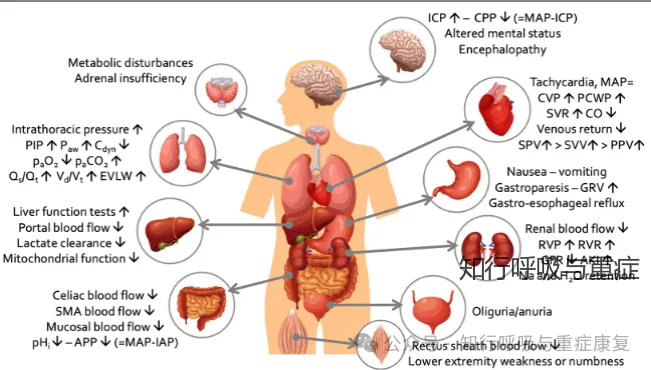
图2 腹内压升高对各个系统的影响(引自2020,Ventilation in patients with intra-abdominal
hypertension)
·二、急性重症胰腺炎对肺部的影响机制 ·
胰腺炎患者肺部并发症的发生率可高达75%。AP初始阶段的肺部表现主要以限制性通气功能障碍为主,可无明显低氧血症。随着病情发展,可表现为弥漫性肺泡损伤、微血管损伤、I型肺泡上皮细胞坏死,以及炎症因子浸润和肺间质水肿导致的渗出性病变,此时可有明显低氧血症和(或)肺部的影像学改变。继而发生Ⅱ型肺泡上皮细胞和成纤维细胞的大量增生,进一步加重肺部病变。
高腹腔压力和全身炎症反应是引起早期肺部损伤的主要原因。异常增高的胸腔内压容易导致胸腔积液、肺不张和气道陷闭等肺部问题,引起气体交换异常。
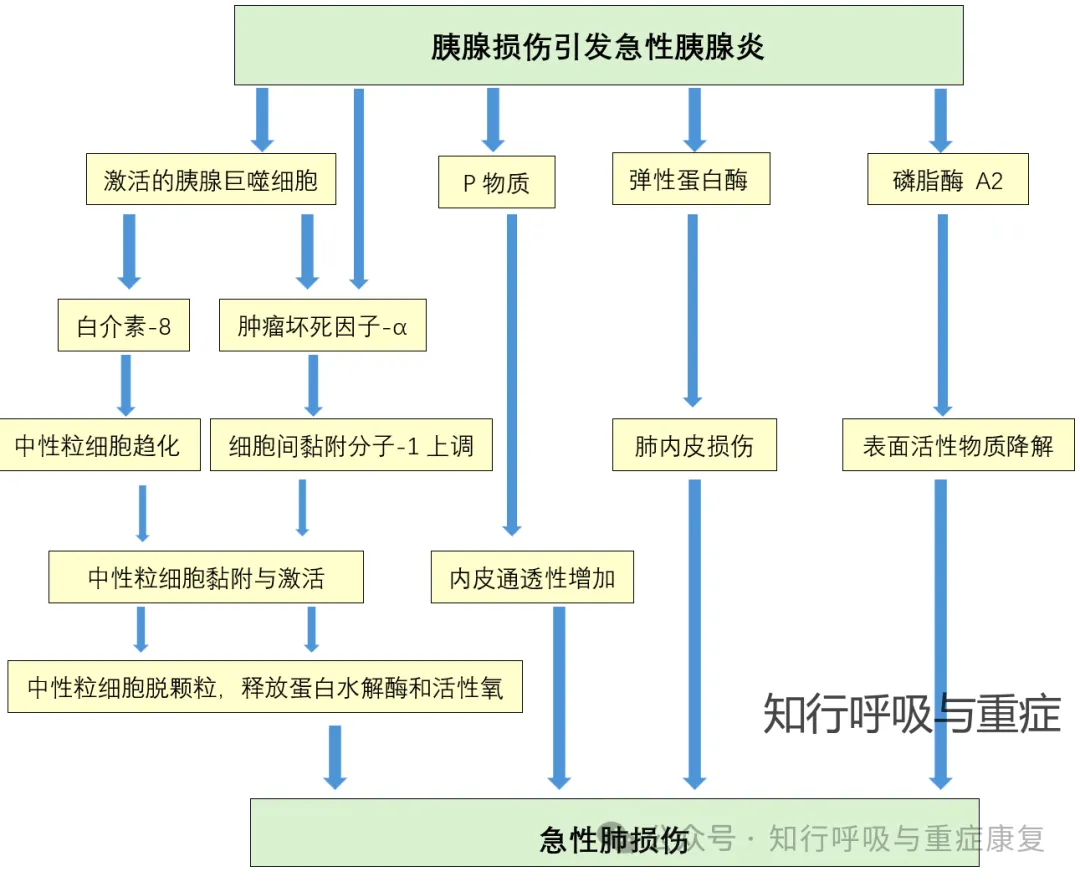
图3 胰腺炎引起的急性肺损伤机制(改编自2020,Acute respiratory distress syndrome in acute pancreatitis)
·三、腹内高压如何影响肺? ·
危重症成人的腹腔内压(IAP)正常值约为5-7 mmHg。腹腔内高压(IAH)的定义为:腹腔内压(IAP)出现持续性或反复性病理性升高,且数值≥12 mmHg。
腹腔内高压(IAH)的分级标准如下:
Ⅰ 级:腹内压(IAP)12-15 mmHg
Ⅱ 级:腹内压(IAP)16-20 mmHg
Ⅲ 级:腹内压(IAP)21-25 mmHg
Ⅳ 级:腹内压(IAP)>25 mmHg
腹腔内压可通过血管压迫、促使膈肌上抬、器官压迫三种途径作用于胸腔,导致胸腔内压力显著升高,进而对肺组织产生外源性压迫,最终引发呼吸功能障碍。
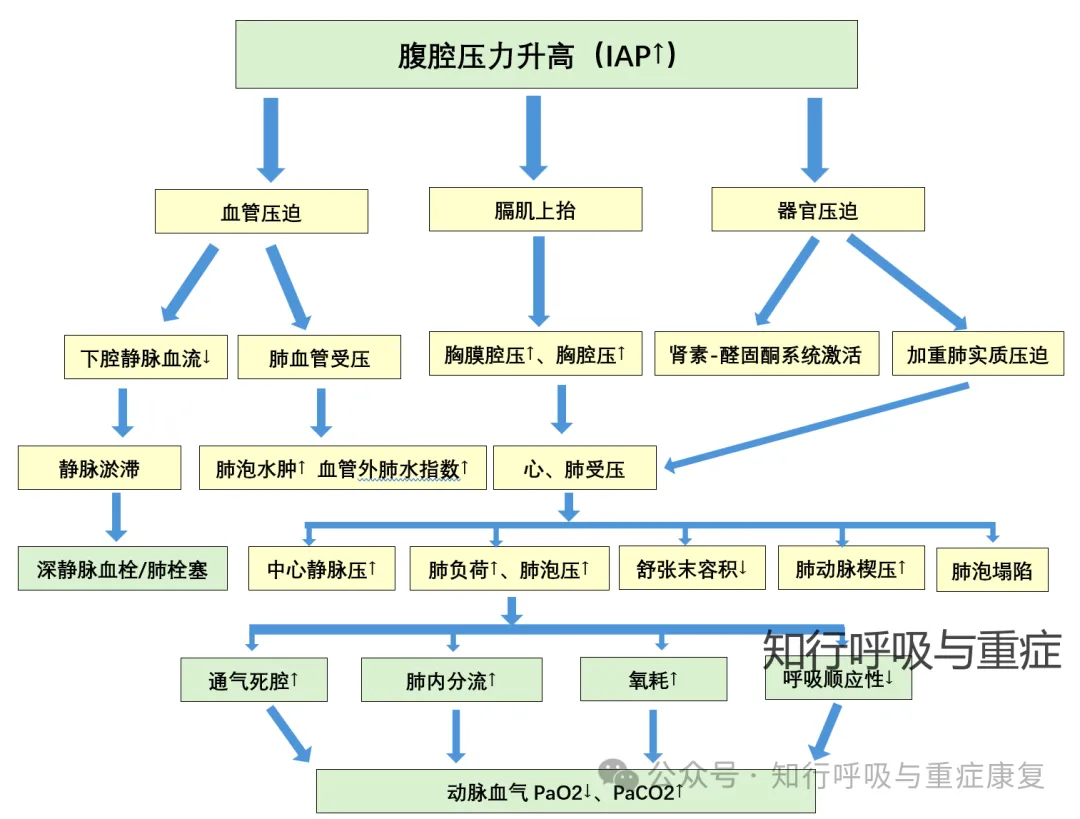
图4腹腔高压影响肺通气换气功能的机制(改编自Respiratory effects of increased intra-abdominal pressure,2007)
当腹腔内压达到16-30mmHg时,肺实质压迫即开始出现,而失血性休克与低血压的发生会进一步加重这一压迫效应。
肺实质受压会引发肺泡萎陷,降低肺毛细血管膜的氧转运效率,并使肺内分流率升高。已有研究证实,腹腔内高压(IAH)诱发的肺泡萎陷会增加肺部感染的发生率。同时,肺实质压迫还会减少肺毛细血管血流量,导致二氧化碳排出减少,肺泡无效腔增大。此外,吸气峰压与平均气道压会显著升高,可能引发肺泡容积伤;自主潮气量与肺动态顺应性则会下降,进一步加剧通气/血流比例失衡。上述多种效应共同作用,最终导致动脉低氧血症与高碳酸血症。
因此,腹高压主要治疗原则是在充分考虑治疗风险的前提下及时采用各种积极有效的措施缓解腹内压,包括胃肠道减压及导泻、各种手段改善胃肠动力(药物及各种中医方法)、镇痛、镇静、使用肌松剂及床边血滤减轻组织水肿,B超或CT引导下腹腔内与腹膜后引流减轻腹腔压力。
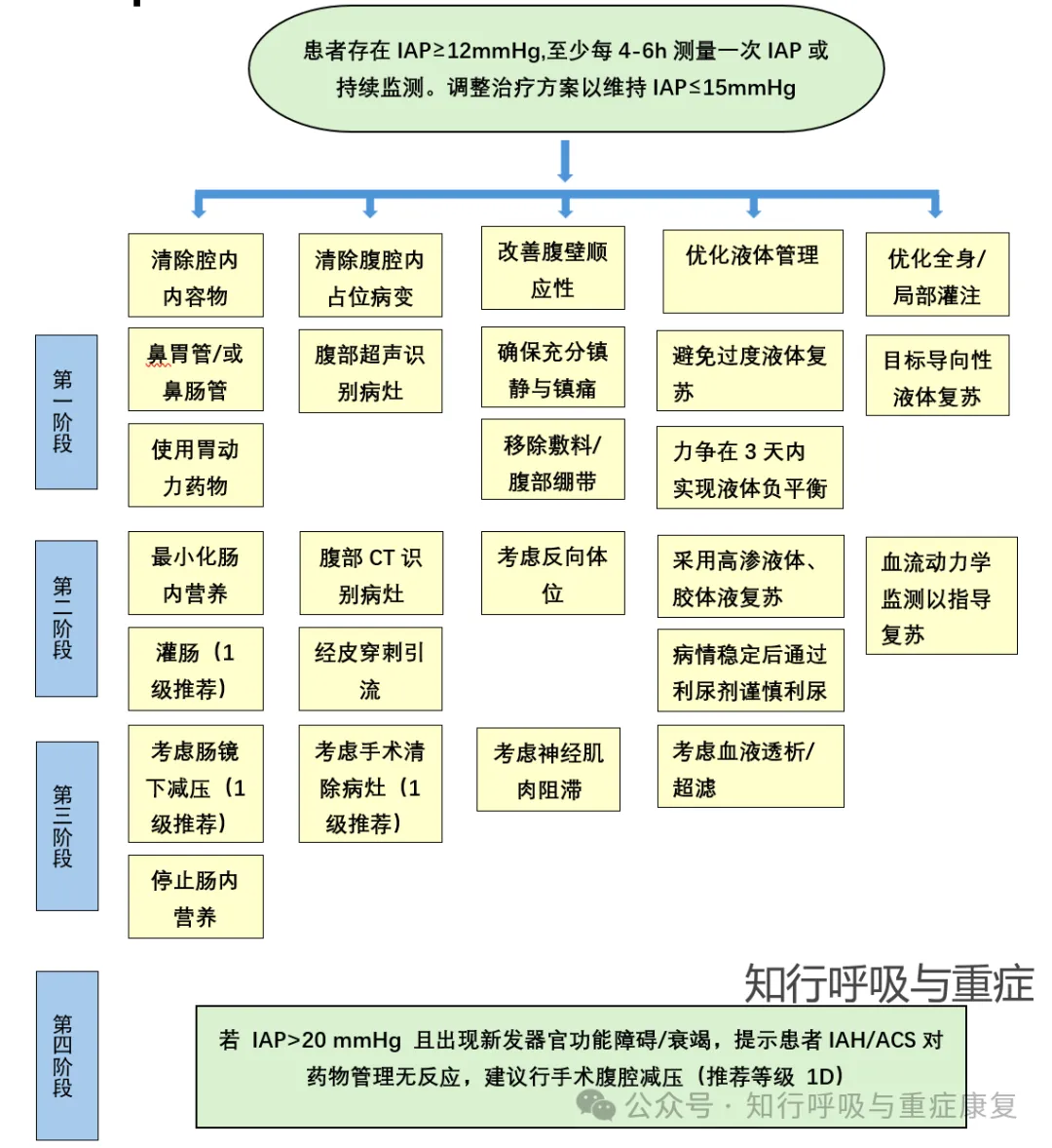
图5 腹内高压的处理(改编自2020,Ventilation in patients with intra-abdominal hypertension)
·四、重症胰腺炎的机械通气策略 ·
在腹内高压(IAH)患者的机械通气管理中,核心通气参数设置需围绕 “平衡肺保护与压力耐受” 展开,要避免肺泡过度扩张或反复塌陷,又要适配IAH 导致的胸壁顺应性下降、胸腹压力传导等病理特点。
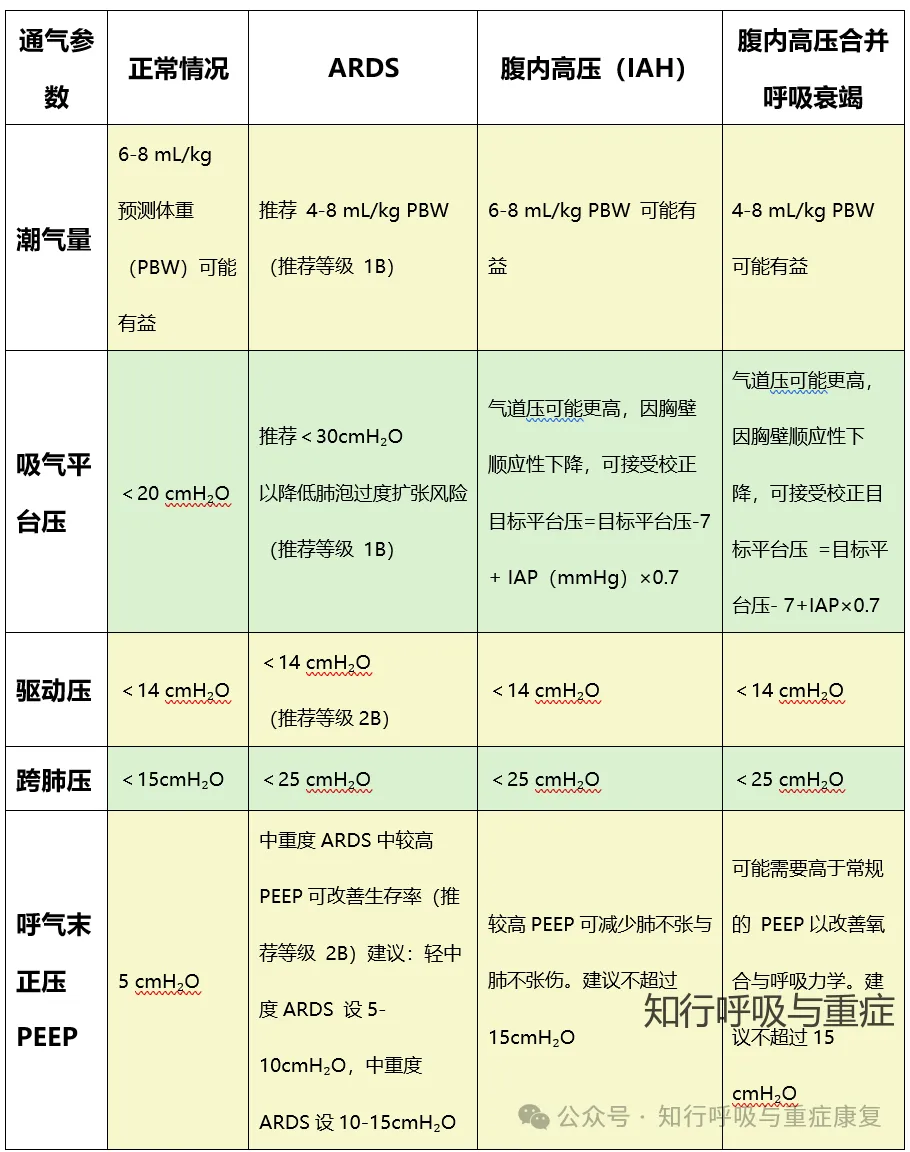
表1 不同患者的机械通气参数设置建议(改编自2020,Ventilation in patients with intra-abdominal hypertension)
1
机械通气模式
目前对于 IAH 患者的最佳通气模式知之甚少,研究以动物实验为主,临床证据有限,核心结论存在差异。
在猪模型中,针对 “轻度至中度 IAH(IAP=15mmHg)+ 肺外源性 ARDS” 的研究发现,辅助通气(如压力支持通气)可通过以减少肺不张、减轻炎症以及改善通气/血流比例改善呼吸功能。
另一项猪模型研究显示,在 “重度 IAH(IAP>20mmHg)” 状态下,辅助通气(如BiPAP 模式下叠加未支持的自主呼吸)带来了不良后果,考虑是重度 IAH 会显著降低胸壁顺应性,患者需付出更大的吸气努力才能维持潮气量,可能导致肺泡过度扩张(非依赖区)与反复塌陷(依赖区),增加剪切应力,最终引发更严重的肺组织病理损伤(如肺泡出血、间质水肿)。其次,此类患者的自主呼吸努力无法有效改善通气效率,反而可能因胸腔内压力波动加剧下腔静脉压迫,进一步降低静脉回流,导致心输出量下降,与完全控制通气相比无明显优势。
因此,在临床中选择模式时应个体化遵循 “分级评估、谨慎启动” 原则。
2
潮气量
所有 IAH 患者(无论是否合并呼吸衰竭)均推荐采用 6-8 mL/kg 预测体重(PBW) 的低肺容积通气;若合并急性呼吸窘迫综合征(ARDS),需进一步降至4-8mL/kg PBW
3
气道平台压
无IAH的 ARDS 患者推荐平台压Pplat<30 cmH₂O,以避免肺泡过度扩张。但由于 IAH 会通过 “胸腹压力传导”(ATT约 20%-60%)使胸腔内压力升高,单纯以 “绝对值<30cmH₂O” 限制 Pplat 会导致跨肺压过低,反而增加肺泡塌陷风险。因此,IAH 患者的 Pplat 可适度放宽,需通过公式校正目标值:
4
驱动压
所有 IAH 患者(无论是否合并 ARDS)均需维持驱动压<14 cmH₂O。即使Pplat因 IAH 校正后升高,只要驱动压在安全范围,VILI 风险仍较低。若驱动压>14 cmH₂O,优先通过 降低潮气量调整
5
呼气末正压(PEEP)
IAH 会升高肺泡闭合压,需更高 PEEP 防止呼气末肺泡塌陷;但过高 PEEP 会增加胸腔压力,降低静脉回流,甚至进一步升高 IAP(尤其在腹内顺应性差的患者中)。因此,PEEP 需个体化滴定,无统一 “最佳值”。在公众号前文已有基于需个体化滴定的方法整理,大家可直接点击跳转→第149期 滴定PEEP的9个方法
此外,对于腹内压高的患者,可以参考IAP的比例设置,基于 “胸腹压力传导率约 50%” 的特点,可尝试将 PEEP(cmH₂O)设置为 IAP(mmHg)的 50%-70%(如 IAP=16 mmHg,PEEP 可设为 8-11 cmH₂O)。临床研究显示,50% IAP 水平的 PEEP 耐受性良好,可改善顺应性且不显著影响循环;而 100%IAP水平的 PEEP 易引发低血压、 气管插管气囊漏气,需避免常规使用。
有人担心增加 PEEP 会导致 IAP 升高。许多已发表的研究发现,PEEP 对IAP的影响很小(如PEEP 从0 cmH₂O增加到15cmH₂O,平均 IAP 仅升高1mmHg)。
· 参考文献 ·
[1]浙江省重症急性胰腺炎诊治专家共识[J].浙江医学,2017,39(14):1131-1150+1161.
[2]Szatmary P, Grammatikopoulos T, Cai W, et al. Acute Pancreatitis: Diagnosis and Treatment. Drugs. 2022;82(12):1251-1276. doi:10.1007/s40265-022-01766-4
[3]Regli A. Ventilation in patients with intra-abdominal hypertension[J]. 2021.
[4]Shah J, Rana S S. Acute respiratory distress syndrome in acute pancreatitis[J]. Indian Journal of Gastroenterology, 2020, 39(2): 123-132.
[5]Malbrain M L. Respiratory effects of increased intra-abdominal pressure[J]. Réanimation, 2007, 16(1): 49-60.