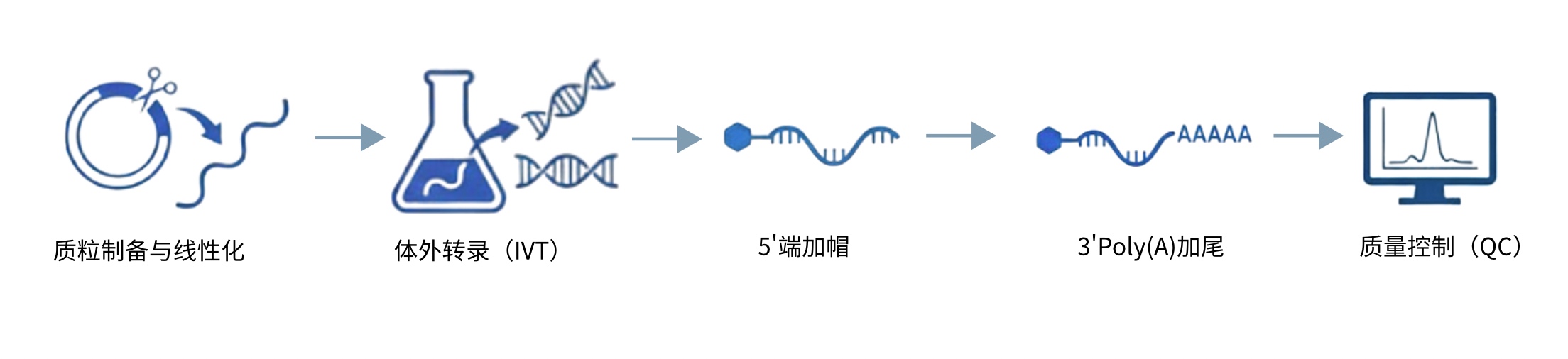
mRNA 疗法凭借精准靶向、快速研发、无基因整合风险的独特优势,已成为生物医药领域的革命性技术,在肿瘤免疫治疗、传染病防控、罕见病治疗等方向展现出巨大应用前景。但 mRNA 分子存在固有短板:作为单链核酸,极易被体内核酸酶降解,自身带负电难以穿透细胞膜磷脂双分子层,且无法有效逃逸内体降解,直接限制其胞内翻译效率与生物活性。因此,高效的 mRNA 包装与递送技术是临床转化的核心前提,而脂质纳米颗粒(LNP)封装技术凭借卓越性能,成为当前 mRNA 递送的主流方案,为 mRNA 疗法落地提供关键支撑。
一、LNP 封装技术的核心原理LNP 通过仿生学设计构建稳定纳米递送载体,其组分协同效应与制备工艺共同保障递送效率,核心逻辑如下:
1. 四大核心脂质组分的功能分工LNP 的高效递送依赖四种脂质组分的精准配合,各成分各司其职、协同作用:
可电离脂质:核心功能组分,中性 pH 下呈电中性,避免与血浆蛋白非特异性结合;进入酸性内体后质子化带正电,与内体膜融合促使内体破裂,实现 mRNA 胞内释放,破解内体逃逸难题;
磷脂:构成 LNP 的双层膜骨架,为颗粒提供结构稳定性,保障递送过程中不被破坏;
胆固醇:嵌入脂质双层,调节膜的流动性与刚性,增强 LNP 在体内循环的稳定性,延长半衰期;
PEG 化脂质:在颗粒表面形成亲水保护层,降低被单核巨噬细胞系统清除的概率,减少颗粒聚集,保证粒径均一性。
2. 制备工艺与颗粒特性LNP 通过标准化工艺实现自组装包裹 mRNA:
主流制备方法包括薄膜水化法、微流控制备法,其中微流控技术因操作精准、可规模化,成为临床级产品的首选;
最终形成粒径 50-100nm 的纳米颗粒,该尺寸既利于穿透肿瘤组织高通透性血管,又能避免肾脏快速滤过,兼顾靶向性与体内循环稳定性。
二、LNP 封装技术的核心优势相较于病毒载体、裸 mRNA、传统脂质体等递送方式,LNP 封装技术具备不可替代的核心竞争力:
1. 生物相容性高,安全性优越LNP 脂质组分多为可生物降解材料,体内可逐步代谢为无毒产物;无病毒载体的免疫原性与基因整合风险,显著降低治疗相关不良事件发生率,临床应用安全性更有保障。
2. 包封与递送效率双高成熟工艺可实现 mRNA 包封率超 90%,能高效介导 mRNA 进入靶细胞,显著提升胞内翻译水平;相比裸 mRNA,LNP 封装后 mRNA 的体内半衰期延长 5-10 倍,生物活性大幅提升。
3. 靶向性灵活可调通过在 LNP 表面修饰靶向配体(如抗体片段、多肽、适配体),可实现对 T 细胞、肿瘤细胞、肝细胞等特定细胞类型的精准递送,减少脱靶效应,提升治疗特异性与疗效。
4. 规模化生产能力强微流控制备等工艺可实现 LNP 的标准化、大规模生产,满足从临床前研究到临床试验的批量需求;生产成本相对可控,工艺稳定性高,具备产业化落地潜力。
三、LNP 封装技术的核心应用领域随着 mRNA 疗法的发展,LNP 封装技术的应用边界持续拓展,覆盖生物医药多个核心方向:
1. 肿瘤免疫治疗递送编码 CAR 基因、肿瘤抗原、细胞因子的 mRNA,实现 CAR-T 细胞快速制备,或激活机体抗肿瘤免疫应答,逆转肿瘤微环境免疫抑制状态;
联合免疫检查点抑制剂,增强 T 细胞活化效率,提升实体瘤治疗效果。
2. 传染病防控LNP-mRNA 疫苗已成功落地,新冠 mRNA 疫苗的广泛应用验证了其高效的抗原表达与免疫诱导能力;
为流感、带状疱疹、呼吸道合胞病毒等传染病的疫苗研发提供全新路径,研发周期较传统疫苗缩短 60% 以上。
3. 罕见病治疗靶向递送缺陷基因的 mRNA,为因基因表达异常导致的遗传病(如囊性纤维化、杜氏肌营养不良症)提供替代治疗方案;
借助 LNP 的组织靶向性,实现病变器官的精准递送,减少对正常组织的影响。
4. 抗体药物研发LNP 介导的 mRNA 递送可在体内或体外高效表达抗体分子,加速抗体药物的筛选与验证进程;
支持双特异性抗体、纳米抗体等新型抗体药物的快速研发,缩短研发周期。
5. 基因编辑辅助与基因编辑技术结合,递送编码 CRISPR-Cas 系统的 mRNA,实现精准基因编辑;
避免 DNA 载体的基因整合风险,提升基因治疗的安全性与精准性。