*仅供医学专业人士阅读参考

哪一类患者最有可能受益于免疫检查点治疗?
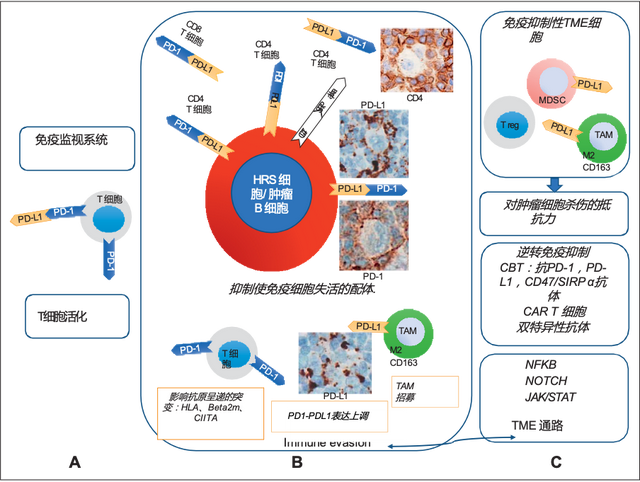
经典霍奇金淋巴瘤(cHL)是一种独特的淋巴瘤,主要特征为肿瘤微环境(TME)中存在大量的Hodgkin Reed-Sternberg(HRS)细胞,混有炎症背景[1]。HRS细胞通过与TME中的免疫细胞及炎症细胞发生串扰(crosstalk)而生长、存活,并通过抑制T细胞介导的免疫反应的机制,从而逃避免疫监视。HRS细胞与其相邻的T细胞之间,通过程序性细胞死亡配体1(PD-L1)——程序性细胞死亡(PD)-1通路作用于T细胞,从而使肿瘤特异性T细胞失活。基于此作用机制,目前检查点抑制抗体在复发或难治性cHL的治疗中显示出良好的治疗效果[2]。研究发现,部分B细胞淋巴瘤显示与cHL相似的炎症性TME,如纵隔B细胞淋巴瘤、弥漫性大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FLs),值得关注的是,表现出与cHL相似的TME的淋巴瘤患者,通常肿瘤细胞也高表达免疫检查点,因此同样受益于免疫检查点抑制剂治疗。进一步解析cHL的TME或可对接受免疫治疗的淋巴瘤患者进行更细致的分层管理。2023年3月10日,顶级期刊Blood在线发表了一项综述——Tumor microenvironment contribution to checkpoint blockade therapy: lessons learned from Hodgkin lymphoma,该文重点探讨了cHL的TME特征及揭示哪些分子表达将会影响个体患者的治疗敏感性或耐药性[2]。具体内容一起和小编看看吧。

肿瘤细胞与TME的功能相互作用
正如在cHL中观察到的那样,B细胞淋巴瘤的肿瘤细胞和TME中的免疫细胞之间发生广泛的交互作用(图1)。在后者中,这种串扰是由HRS细胞表达的大量细胞因子和趋化因子网络或由不同细胞类型的TME产生的分子介导的,如CD30/CD30L、CD40/CD40L、OX40L/OX40、Il-3/Il-3R、CCR5/CCL5以及PD-L1/PD-1等。
其中,炎症通路NF-κB和JAK-STAT途径在HRS细胞及TME中广泛激活。在正常情况下,NF-kB信号通路的活化,应通过刺激CD30、CD40、RANK以及OX40L等各种受体,从而发生级联反应。但在HRS的替代NF-κB途径中,通过刺激NF-κB诱导激酶(MAP3K14)即可激活NF-κB通路,从而产生大量炎症因子。另一条炎症通路——JAK-STAT途径,在cHL的TME中通过基因组的增益突变或JAK2基因易位介导。另外,HRS细胞中另一个构成性活性信号通路——NOTCH1通路,NOTCH1由HRS细胞高度表达,其配体JAGGED1由微环境中的细胞或HRS细胞本身提供。在cHL细胞系中,NOTCH1信号传导促进HRS细胞存活和增殖。
基因表达谱的证据表明,TME的组成可能取决于Epstein Barr病毒肿瘤的状态。此外,HRS细胞的测序相关的基因表达研究表明,HRS细胞的基因型和表型深度影响TME内的细胞间交互反应。总体而言,这种串扰显示了疾病的生物学复杂性,对于HRS细胞的生长和存活至关重要。同样,除cHL以外的B细胞淋巴瘤,也通过与微环境细胞形成突触,以促进肿瘤进展并介导免疫逃避。

免疫检查点抑制剂的作用机制
在多种实体瘤中,CD8+细胞毒性T细胞被认为是杀伤肿瘤细胞的主要效应细胞。然而在cHL中,大多数HRS细胞表达主要组织相容性复合体(MHC)II类分子,可被CD4+T细胞识别,并呈递新型肿瘤抗原,这一过程与免疫检查点抑制剂发挥疗效息息相关,因此,cHL中的炎症浸润主要由CD4+T细胞主导。
此外,已有学者提出了PD-1+NK细胞和PD-L1+单核细胞/巨噬细胞在cHL的TME中的作用机制。PD-1+NK细胞和PD-L1+单核细胞/巨噬细胞,在cHL的TME出现了明显的扩增。阻断PD-1将逆转由PD-1+NK细胞以及PD-L1+单核细胞/巨噬细胞介导的的免疫逃避。
MHC I类和/或II类分子的表达下调,可能会损伤cHL或其他淋巴瘤中PD-1/PD-L1阻断剂疗法的疗效,同时,在cHL和原发性纵隔大B细胞淋巴瘤(PMBCL)中,参与抗原呈递的几类基因常常出现突变,如MHC I类和II类基因位点6p21.32的缺失降低了MHC II类在细胞表面的表达,此外,MHC II类分子融合基因的结构变异是淋巴瘤中常见的基因突变类型,其改变见于15%-38%的PMBCL,15%的cHL以及<5%的DLBCL患者,此类患者对免疫疗法的响应率低于其他非突变肿瘤。
抗PD-1治疗对淋巴瘤的疗效
早期临床试验已经证明了抗PD-1在cHL和PMBCL疾病中的显着疗效,这两类疾病具有PD-L1过表达的转录谱和机制。但相比之下,抗PD-1在FL和DLBCL中的疗效令人失望。
抗PD-1治疗已被证实明显著改善复发/难治性cHL患者结局。在brentuximab vedotin和/或同种异体移植(ASCT)治疗失败的患者中,使用抗PD-1抗体纳武利尤单抗或帕博利珠单抗进行的临床试验表现出前所未有的缓解率,平均完全缓解率为22%,部分缓解率为65%,并且有一部分患者在纳武利尤单抗或帕博利珠单抗治疗后出现了持久缓解。基于这些试验,美国食品药品监督管理局(FDA)加速批准了纳武利尤单抗用于治疗ASCT后疾病复发或进展的cHL患者,以及批准帕博利珠单抗治疗brentuximab vedotin和/或ASCT治疗失败的成人和儿童难治性cHL患者,或者既往接受≥3线治疗后疾病复发的患者。
最近的试验研究了PD-1阻断剂在ASCT巩固后的一线治疗有效性。虽然PD-1阻断剂在这类患者中的的最佳适应症仍是一个有待商榷的问题,但已有研究对PD-1阻断剂在病程中所有时间点的疗效的进行了报告。另有非随机研究支持将PD-1阻断剂作为复发风险高的cHL患者在ASCT后的巩固治疗。
小结
拓扑分析显示,在cHL的TME中PD-L1的大部分由PD-L1+TAMs表达,其与PD-L1+HRS细胞在物理上共定位。PD-L1+TAM和PD-L1+HRS细胞在与CD4+T细胞接触时富集,而这类CD4+T细胞的多表达PD-1。这些数据也进一步定义了cHL的独特拓扑结构,侧面印证了CD4+T细胞是PD-1阻断的重要靶点。此外,根据最近的探索性研究显示,免疫调节细胞(如Treg、MDSC细胞)的定量和空间评估,是评估治疗敏感性或耐药性的重要工具。这些数据虽然具有科学相关性,但目前的科技无法精确区分参与信号通路的分子,因此无法直接进行“微环境识别”,从而对淋巴瘤患者进行治疗分层。基于此,在未来,淋巴瘤的研究方向应进一步探索创新的检测方法,以揭示哪些分子可作为预测治疗敏感性或耐药性的关键靶标。参考文献[1]Biological agents [J]. IARC Monogr Eval Carcinog Risks Hum, 2012, 100(Pt B): 1-441.[2]CARBONE A, GLOGHINI A, CARLO-STELLA C. Tumor microenvironment contribution to checkpoint blockade therapy: lessons learned from Hodgkin lymphoma [J]. Blood, 2023, 141(18): 2187-93.*本材料由阿斯利康提供,仅供医疗卫生专业人士参考,不用于推广目的。审批编号:CN-118859 有效期至:2023-10-13* 此文仅用于向医学人士提供科学信息,不代表本平台观点
