神经病理性疼痛是一种由神经系统损伤或疾病引发的疼痛,它可能表现为烧灼感、麻刺感、锐痛或刺痛,严重影响患者的生活质量。需要综合考虑药物治疗和非药物治疗,包括抗抑郁药、抗癫痫药、局部利多卡因、阿片类药物等,以及物理治疗、心理治疗和神经调控技术等。神经痛常见症状包括冷痛觉超敏和冷痛觉过敏,其发病机制不明,有待进一步的研究。
近日,复旦大学基础医学院米文丽团队在线发表了题为“Transient receptor potential melastatin 8 contributes to the interleukin-33-mediated cold allodynia in a mouse model of neuropathic pain”的论文。该研究使用了CRISPR/Cas9技术、特异性敲除小鼠模型、活细胞钙成像技术和全细胞膜片钳技术,揭示了在神经病理性疼痛模型中,IL-33/ST2信号通路通过与冷感受器TRPM8相互作用,对冷痛觉超敏有重要影响。其结果不仅阐明了IL-33/ST2信号通路在神经病理性冷痛中的作用机制,而且为治疗提供了潜在的靶点。

研究背景
神经病理性疼痛是一种常见的慢性疼痛症状,其发病机制复杂,常规镇痛药物疗效不佳。冷痛觉超敏作为神经病理性疼痛的一个主要症状,其机制尚不完全清楚。IL-33/ST2信号通路已知在多种疾病中发挥作用,但在神经病理性冷痛中的具体作用和机制仍不明确,这限制了针对该通路的治疗策略的开发。
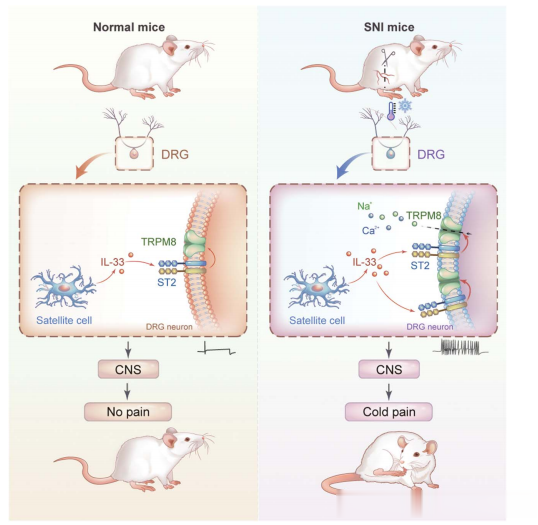
研究思路

整篇文章的研究设计路线从行为学测试到分子机制探究,再到药物干预和基因操作,逐步深入地揭示了IL-33/ST2信号通路在神经病理性冷痛中的作用及其潜在的治疗靶点。
研究结果
1.IL-33/ST2信号对神经病理性冷痛的必要性
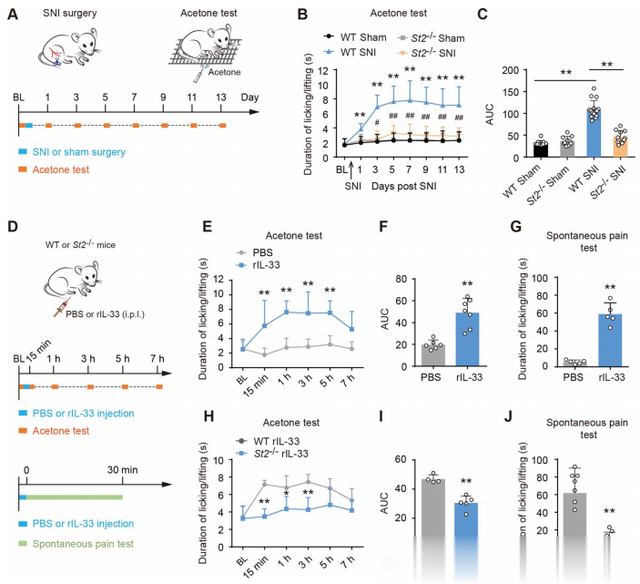
通过SNI手术建立的小鼠模型后,作者发现ST2基因敲除(St2-/-)显著减少了对冷刺激的敏感性,表现为舔/抬脚的持续时间减少。此外,rIL-33的局部注射足以在正常小鼠中诱发冷痛行为,而ST2基因敲除小鼠则未能表现出这种冷痛。结果表明,IL-33/ST2信号对于神经损伤后冷痛行为的发生是必需的。
2.IL-33和ST2在小鼠和人DRG中的表达
作者使用RNAscope荧光原位杂交技术和免疫组织化学分析,发现ST2 mRNA与多种痛觉相关标记物共表达,如CGRP、IB4和NF200。此外,ST2的表达也存在于人类DRG神经元中,这为研究结果的临床转化提供了基础。IL-33主要与GFAP共表达,表明IL-33可能主要由DRG中的GFAP标记细胞产生。这些发现为IL-33/ST2信号在痛觉传递中的作用提供了重要的细胞和分子证据。

思考问题:上述提到的ST2 mRNA与CGRP、IB4和NF200痛觉相关标记物共表达,这些标记物在痛觉传递中扮演什么角色?
ØCGRP:降钙素基因相关肽是一种神经肽,尤其在炎症和神经病理性疼痛中起到重要作用。CGRP阳性神经元通常与对疼痛刺激的敏感性增加有关。
ØIB4:IB4是一种凝集素,它可以结合到特定的糖蛋白上,常用于识别未髓鞘化的C纤维神经元,这些神经元参与传递疼痛信号,特别是那些与炎症相关的疼痛。
ØNF200 :神经丝蛋白200是一种神经元的结构蛋白,存在于许多类型的神经元中,包括痛觉神经元。NF200的表达可以反映神经元的大小和成熟度,但它在痛觉传递中的具体作用尚不完全清楚。
3.痛觉神经元中ST2对神经病理性冷痛的影响
利用CRISPR/Cas9技术产生的St2条件性敲除小鼠模型,作者发现在Nav1.8阳性痛觉神经元中特异性敲除ST2可以显著降低SNI诱导的冷痛行为。此外,电生理记录显示ST2基因敲除减少了SNI后DRG神经元的异常放电,表明ST2在痛觉神经元的过度兴奋中起着调控作用,对神经病理性冷痛发展起到重要调控作用。

4.TRPM8在IL-33诱导的冷痛中的作用
rIL-33能够通过TRPM8在DRG神经元中诱导Ca2+内流,并且这种效应可以通过TRPM8阻断剂AMTB抑制。此外,TRPM8阳性神经元的特异性敲除显著减少了rIL-33诱导的冷痛行为。结果表明TRPM8是IL-33/ST2信号通路中的一个重要介质,参与了神经病理性冷痛的发生。研究还发现ST2和TRPM8在DRG神经元中共表达,并可能通过蛋白质相互作用来调节冷痛。

文章小结
该研究聚焦于IL-33/ST2信号通路在神经病理性冷痛中的作用,是疼痛研究领域中的一篇优秀工作。具有多层次的实验设计,不仅在整体动物水平进行行为学测试,还在细胞和分子水平进行了一系列实验,包括Ca2+成像、电生理记录、免疫共沉淀等,这为揭示IL-33/ST2信号通路的作用机制提供了多角度证据。最后,揭示了IL-33/ST2信号通过与TRPM8相互作用来调节神经病理性冷痛的新机制,为疼痛治疗提供了新的靶点。