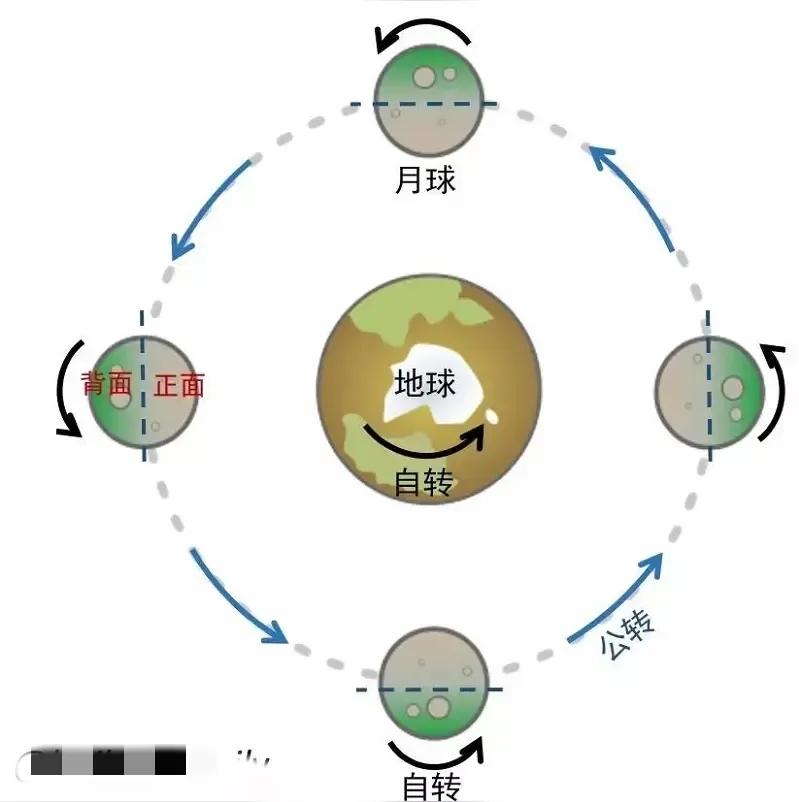
反应动力学的基本理论,重点研究了电化学反应的能级电化学反应牵涉到Ox)或还原剂(Rd)之间的,因此这一反应与。图1是电极/电解液界面电子转移的能级-能态密度示意图。
。外加于金属电极的电位将改变金属的Fermi能级,即改变电子的能量。
阴极极化F2(a)),使电子的能量升高,有利于还原反应的发生。则使E向下移动(图图2. 改变电极电位对电子转移的能量的影响。(a)阴极极化;(b)阳极极化。
电化学反应的电流-电位方程
Ox+ne–Rdc和RdNernst关系:
=φ⊖′/*C/C(2)
k,反应速率和反应电流分别为fi;后向反应(氧化反应或称为阳极反应)的速率常数为bv和aV=fOx0,t)=i/(3)
bKC(anFA式中Ox0,t)和c(总的电化学反应为阴极电流和阳极电流之差,即
-iaCoxCRd图3. 电化学反应活化能观察图0,c0,a若电极电位φ从0V向正方向移动到+E,则电极上电子的能量将改变-nFE(能量下降),因此,(Ox+e)曲线向下移。
aa‡,即小于能量变化的某一分数,取为(–α),α的值可以从0到1,这样
=ΔG‡–1-nFE(从图还原反应(阴极反应)的活化能也起了变化,电极电位等于E时的活化能比φ=0时大>ΔG‡,即大总能量变化的α倍,这样
c0,c7)
k和bArrhenius形式
ffΔG†/)(8)
=AbΔG†aRT将(6)式的ΔG‡代入(9)式,(7)式的ΔG‡ck=Aexp(-0,cRTexp(-RTk=Aexp(-0,aRTexp[(1-RT]当k⊖=Aexp(-0,cRTk⊖bexp(-0,aRT再设10)式和(11)式可以写成下列形式:
ffαnfφ)(12)
bbα)nfφ](13)
=CbRdOx0,t)=,Rd0,t)=,fbCboxCbRd,当Cbox=CbRd时,有φ=φ⊖′,再从(12)式和(13)式得
ffαnfφ⊖′k=k⊖exp[(1-]k⊖k⊖k⊖f(–αnfφ⊖′k⊖b[(1-α)nfφ⊖′式中⊖将上述的代入(12)式和(13)式,得
fexp[–)(17)
bexp[(1-–)(18)
电流:
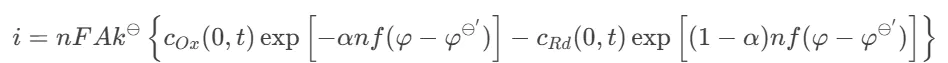
上面提到的电子传递系数,即
–)/0当活化能较高(电子转移速率较低)、φφ⊖′使用交换电流0k⊖–φeq(2.1)直接联系起来i,得
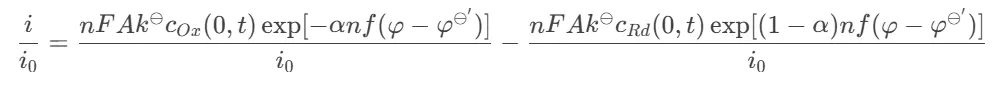
-过电位方程应该注意,上式右端括号中的第一项代表阴极电流成分,第二项为阳极电流成分,并且一直假定阴极电流为正。
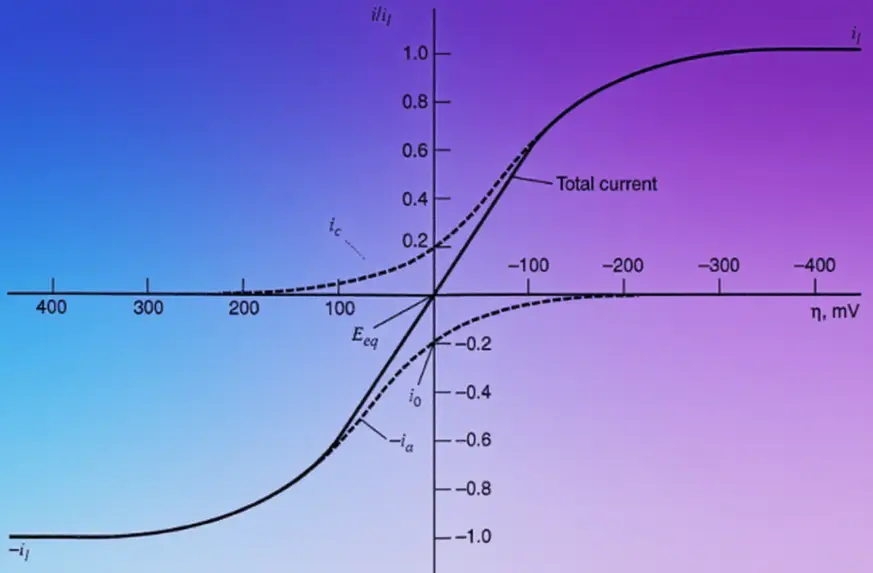
图η曲线。实验为实际的总电流,是阴极电流ciai和分别由虚线表示。
高度阴极极化区高度阳极极化区另外,无论是阴极极化还是阳极极化,当过电位很高时,电流都趋于一个饱和值,这时电流为溶液中传质过程所限制,出现i表示。
Butler-Volmer方程
/溶液界面的电荷迁移过程快得多,使得,即
Ox0,t)=Oxc(Rd
-过电位方程可简化为
0αnfη)[(α)nfη)](2.4)
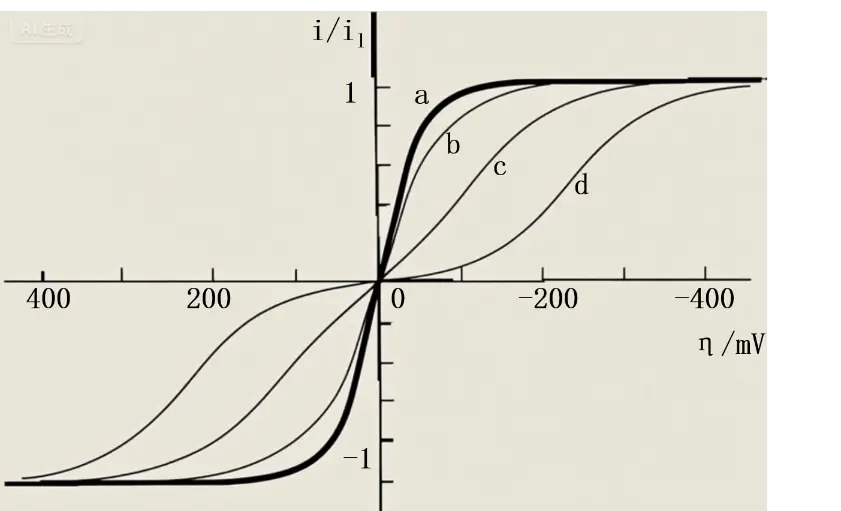
Butler-Volmer方程限电流中较小者的大约图5为按(2.4)式计算的不同交换电流密度j-n=1,α=0.5。在这种情况下,。
对于同一个净电流,交换电流越小,活化过电位越大a那样,活化过电位就很小。对于这一类电极反应,如果发生图5. 交换电流密度对j-η曲线的影响。
对于同一个反应电流,随着α的增大,阴极过电位减小,而阳极过电位增大当∣nfη∣≪4)式可以进一步简化成
01αnfη(1+(α)nfη]
i=-infη图6. 传递系数对j-η曲线的影响。
–2.–电荷传递电阻ctR=nf=RTnFi(2.6)
R与交换电流0i较大的反应,或者说对于标准速率常数较大的反应,cti较小时,ctRct也可以用来表示电极反应动力学的快慢,它也是一个重要的动力学参数R可以通过交流阻抗方法进行测量。
质传递效应对电流-过电位方程的影响
i-(3.1)
i/i值时,依照上述计算的η理论关系曲线。图中0lη关系,此时过电位完全由质传递过程所引起。
i-i/i的变化,曲线相应的0l当过电位很小时,严格地说,当≪αnfη)≈1αnfη和α)nfη]≈1+(1α)nfη。
(3.2)l,c1,i/i≪3.2)式变为
/0/l,c/l,a(3.3)
η=/i0/l,c/l,a1/(nfi)和l,aR和mt,aR=nfi,mt,a1/l,a因此(3.4)式又可以改写成η=-i(Rct+mt,cR)(3.6)
i很大时,即当ctR+R时,在平衡电极电位附近,过电位主要是取决于浓差极化。反过来,如果0R≫mt,+mt,a