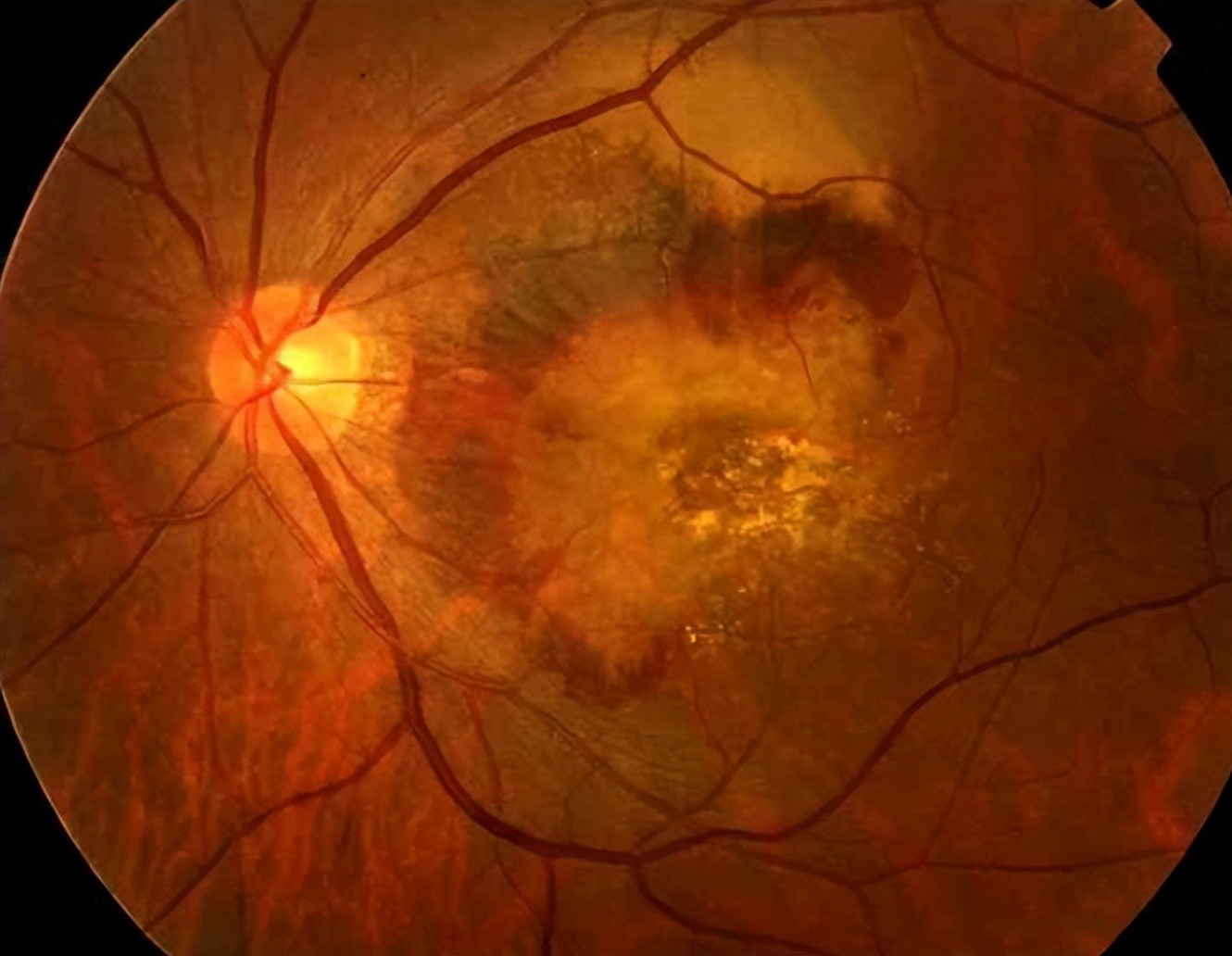
糖尿病患者的世界里,除了血糖仪上的数字,还有一双时刻被“威胁”的眼睛——糖尿病视网膜病变(DR)是成人失明的主要诱因之一。传统治疗聚焦于控制血糖和抑制眼底血管异常增生,但美国阿拉巴马大学的研究揭示了一个新真相:肠道菌群代谢产物竟是影响眼底健康的“远程遥控器”。通过肠菌移植(FMT)调节菌群代谢,或能为DR患者点亮“光明希望”。
一、DR的“双重暴击”:血管与神经的双重损伤
DR的本质是微血管病变与神经退变的“双重打击”:
1.微血管病变:长期高血糖损伤视网膜毛细血管内皮细胞,导致血管通透性增加,血液成分渗漏,引发黄斑水肿;随后,缺血区域释放血管内皮生长因子(VEGF),刺激异常新生血管生成,这些血管脆弱易破裂,造成玻璃体积血甚至视网膜脱离。
2.神经退变:糖尿病神经性病变(DPN)不仅影响四肢感觉,还会累及视网膜神经节细胞,导致视觉信号传递障碍,加速视力下降。研究显示,约50%的DR患者存在视网膜神经纤维层变薄,且神经损伤程度与血管病变严重度正相关。
3.这两者互为因果:微血管病变导致视网膜缺血,诱发神经炎症;神经退变又削弱血管自稳能力,形成恶性循环。而肠道菌群,正是这一循环中的“关键变量”。
二、肠道菌群:眼底健康的“代谢信使”
健康肠道菌群通过代谢产物(如短链脂肪酸、色氨酸衍生物)与视网膜“远程对话”,维持血管与神经稳态;而菌群失调时,这种对话被打破,DR风险骤增。
1. 吲哚-3-丙酸(IPA):血管稳定的“守护者”
色氨酸是人体必需氨基酸,肠道菌群(如乳酸杆菌)可将其代谢为IPA。IPA通过血液循环到达视网膜,发挥双重保护作用:
抑制VEGF过度表达:高血糖会激活视网膜 Müller 细胞的VEGF通路,促进新生血管生成;而IPA可阻断这一信号,减少异常血管形成。
抗炎抗氧化:IPA抑制视网膜小胶质细胞活化,降低促炎因子(如IL-1β、TNF-α)水平;同时清除自由基,减轻氧化应激对血管内皮的损伤。
2. 短链脂肪酸(SCFA):神经与血管的“双重滋养”
双歧杆菌、阿克曼菌等有益菌发酵膳食纤维生成丁酸等SCFA,它们对视网膜的保护作用体现在:
保护神经节细胞:丁酸促进视网膜神经节细胞存活,增强其对抗高血糖损伤的能力;同时通过血脑屏障,改善视神经传导功能。
强化血管屏障:丁酸增加视网膜血管内皮细胞间紧密连接蛋白表达,减少血液成分渗漏,缓解黄斑水肿。
3. 脂多糖(LPS):“促炎炸弹”的制造者
菌群失调时,促炎菌(如大肠杆菌)增多,肠黏膜屏障通透性增加,LPS进入血液,激活全身免疫系统。LPS可通过TLR4受体激活视网膜小胶质细胞,释放VEGF和炎症因子,加速DR进展。
三、糖尿病神经性病变:菌群-眼底对话的“干扰器”
DPN不仅直接损伤视网膜神经,还会通过破坏肠道-神经轴,间接扰乱菌群代谢:
1.肠道动力异常:DPN导致肠蠕动减慢,便秘高发,促进有害菌过度生长,减少IPA和SCFA生成。
2.神经信号中断:迷走神经是肠道菌群与大脑(包括视网膜)对话的“高速公路”,DPN损伤迷走神经后,菌群代谢产物无法有效传递至视网膜,削弱保护作用。
3.代谢反馈失灵:DPN患者对血糖波动的感知下降,饮食控制能力减弱,高血糖进一步加剧菌群失调,形成“神经性病变-菌群失调-DR恶化”的闭环。
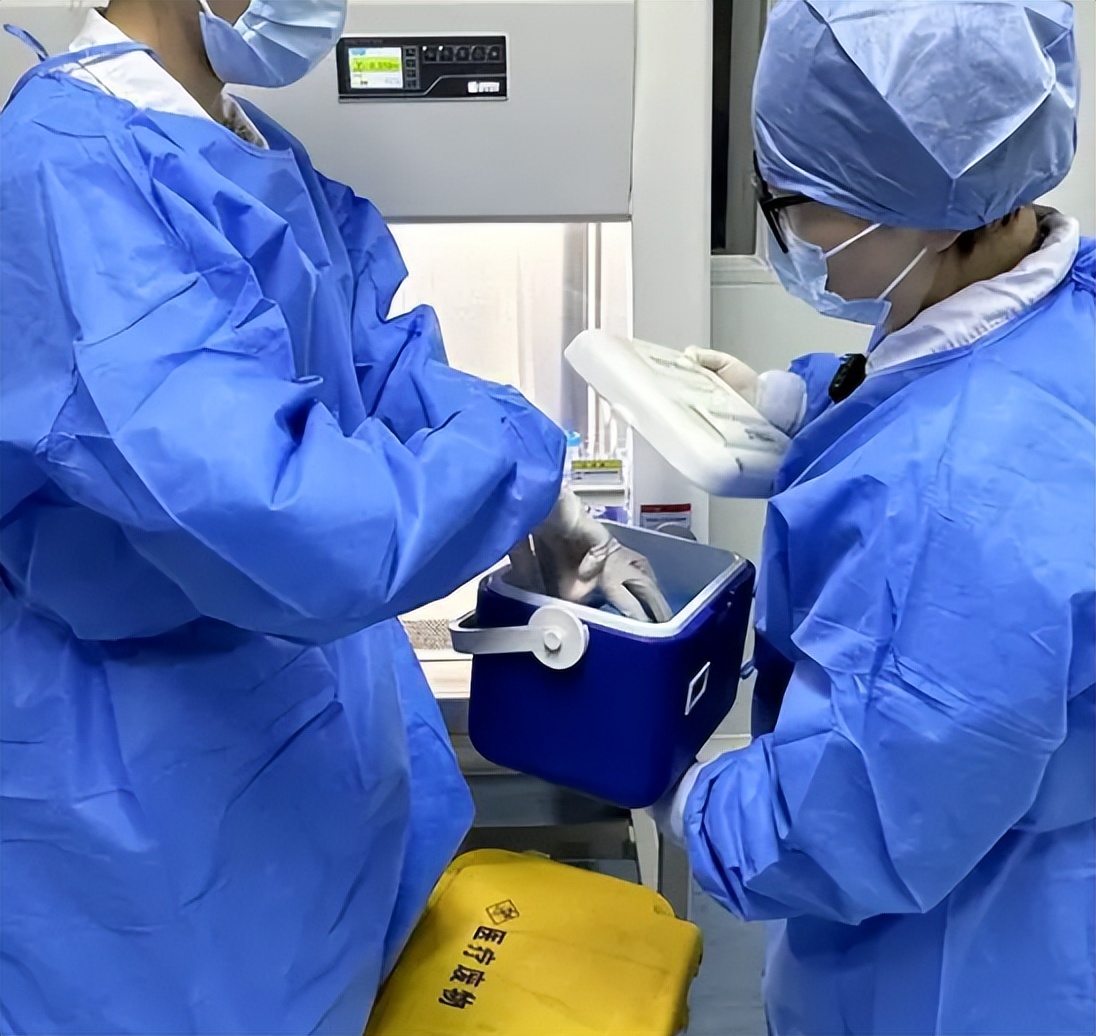
美国阿拉巴马大学的临床试验为FMT治疗DR提供了直接证据:20例增殖性DR患者接受FMT后,血清丁酸水平升高40%,LPS降低35%,视网膜新生血管面积减少25%。这一效果源于FMT的“代谢重置”作用:
2.补充有益菌:供体菌群中的乳酸杆菌、双歧杆菌等迅速定植,恢复IPA和SCFA生成,直接抑制VEGF和炎症通路。
3.修复肠黏膜屏障:FMT减少肠漏,降低LPS入血,减轻全身炎症对视网膜的“远程攻击”;
4.改善神经功能:通过恢复肠道-神经轴信号传递,FMT间接缓解DPN,打破“神经-菌群-DR”恶性循环。
DR的防治不能仅盯着眼底,更需关注肠道这个“代谢枢纽”。FMT通过调节菌群代谢,不仅抑制眼底异常血管生成,还保护视网膜神经,为DR患者提供了“标本兼治”的新选择。未来,随着对菌群-视网膜轴机制的深入研究,FMT有望与抗VEGF药物、激光治疗等联合,形成“多靶点干预”方案,让更多糖尿病患者“看得见”未来的光明。







